โครงสร้างทางเคมีสมบัติและการใช้ประโยชน์ของแมงกานีสออกไซด์ (MnO2)
แมงกานีสออกไซด์ (MnO2) เป็นสารประกอบทางเคมีอนินทรีย์ที่เกิดจากแมงกานีสองค์ประกอบที่มีหมายเลขออกซิเดชัน +4 และออกซิเจนซึ่งในการก่อตัวของออกไซด์มีหมายเลขออกซิเดชันของ -2 มันเป็นที่รู้จักกันโดยชื่อของแมงกานีส (IV) ออกไซด์และแมงกานีสแอนไฮไดรด์.
มันเป็นของแข็งจากกาแฟเข้มถึงดำ มันมีอยู่ตามธรรมชาติเช่นเดียวกับแร่ pirolusite, dendrites ที่ก่อตัวเป็นสีดำและตกผลึก มันสามารถได้รับเป็นสารตกค้างสีดำในปฏิกิริยาระหว่างเอทิลีนและโพแทสเซียมเปอร์แมงกาเนตหลังจากการก่อตัวของไกลคอลโดยการออกซิไดซ์ของโพแทสเซียมเปอร์แมงกาเนต.

มันมีความสำคัญมากในอุตสาหกรรมแก้วเนื่องจากคุณสมบัติของตัวออกซิไดซ์เนื่องจากมันกำจัดสีเขียวที่มาจากสารประกอบเหล็กและแปลงให้เป็นเหล็ก.
ดัชนี
- 1 โครงสร้างทางเคมี
- 2 คุณสมบัติ
- 3 ใช้
- 3.1 เป็นตัวเร่งปฏิกิริยา
- 4 ผลกระทบต่อสุขภาพ
- 5 อ้างอิง
โครงสร้างทางเคมี
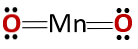
โครงสร้างทางเคมีของสารประกอบสอดคล้องกับของแอนไฮไดรด์และไม่ใช่ของออกไซด์พื้นฐานอย่างที่ควรจะเป็นเพราะมันประกอบด้วยโลหะและไม่ใช่โลหะ.
กรณีพิเศษนี้เกิดจากพฤติกรรมของแมงกานีสในสภาวะออกซิเดชันที่แตกต่างกัน ดังนั้นสำหรับสถานะออกซิเดชัน +2 และ +3 รูปแบบออกไซด์ MnO และ Mn2O3 ตามลำดับเมื่อทำปฏิกิริยากับน้ำจะเกิดแมงกานีสไฮดรอกไซด์และแมงกานีสไฮดรอกไซด์ตามลำดับ.
อย่างไรก็ตาม Mn2O3 ในสื่อที่เป็นกรดเล็กน้อยมันทำตัวเหมือนแอนไฮไดรด์ ด้วยสถานะออกซิเดชัน +4, +6 และ +7, MnO2, MnO3 และ MnO4 พวกมันก่อกรดเมื่อทำปฏิกิริยากับน้ำ.
ในสื่อที่เป็นกรดเล็กน้อย MnO2 มันทำตัวเหมือนออกไซด์พื้นฐานดังนั้นมันจึงสามารถสร้างไฮดรอกไซด์ที่เกี่ยวข้องได้.
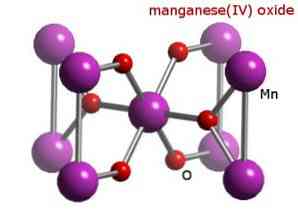

มันจะต้องเป็นพาหะในใจว่าในกรณีนี้ไม่มีการเอ่ยถึงคุณสมบัติ amphoteric ตามที่สารประกอบสามารถทำงานเป็นกรดหรือเป็นฐาน นี่เป็นกรณีพิเศษของพฤติกรรม Mn.
สรรพคุณ
การใช้งาน
- มันถูกใช้เป็นแหล่งของแมงกานีส
- เป็นสารต่อต้านอนุมูลอิสระในแบตเตอรี่อัลคาไลน์
- สีสำหรับแก้วเซรามิกและพอร์ซเลน.
- ในการรับคลอรีนและไอโอดีน.
- ในการสลายตัวของไฮโดรเจนเปอร์ออกไซด์สำหรับการก่อตัวของก๊าซออกซิเจนและน้ำ.
- ในปฏิกิริยาการสลายตัวของโพแทสเซียมคลอเรตสำหรับการผลิตก๊าซออกซิเจนและโพแทสเซียมคลอไรด์.
- ละลายในอะซิโตนหรือไดคลอโรมีเทนออกซิไดซ์แอลกอฮอล์เบื้องต้นกับอัลดีไฮด์และทุติยภูมิเป็นคีโตน.
- การผลิตแบตเตอรี่อัลคาไลน์.
เป็นตัวเร่งปฏิกิริยา
สิ่งนี้ใช้กับปฏิกิริยาการลดออกไซด์สำหรับการกำจัดซัลไฟด์เช่น H2S และไพเพอร์เช่นเฟ+2 และ Mn+2 , สารหนูและวิทยุที่พบในน้ำใต้ดินที่ปนเปื้อนด้วยสารประเภทนี้.
การปนเปื้อนนี้สามารถเกิดขึ้นได้โดยการทิ้งสารพิษที่ไม่สามารถควบคุมได้โดยการล้างดินที่ปนเปื้อนหรือจากการปรากฏตัวขององค์ประกอบทางเคมี ณ เวลาที่ทำการสกัดน้ำ.
MnO2 ความบริสุทธิ์สูงที่ได้จาก pyrolusite ที่ใช้เป็นตัวกรอง (Filox) เป็นวิธีที่มีประสิทธิภาพมากที่สุดในการกำจัดสิ่งสกปรกในชั้นนี้ออกจากน้ำใต้ดิน.
ผลกระทบต่อสุขภาพ
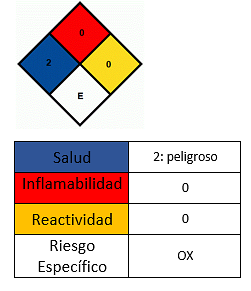
- หลีกเลี่ยงการสัมผัสกับผิวหนัง.
- ในกรณีของการติดต่อล้างพื้นที่ที่สอดคล้องกัน.
- อย่าสูดดมผง.
- ระคายเคืองและตาแดงเมื่อสัมผัสทางดวงตา ล้างด้วยน้ำปริมาณมากปล่อยให้น้ำไหลผ่านดวงตาและขอความช่วยเหลือจากแพทย์ในกรณีที่ร้ายแรง.
- เมื่อสัมผัสกับผิวหนังระคายเคืองและแดง ล้างบริเวณที่ปนเปื้อนด้วยน้ำและสบู่ปริมาณมาก.
- การสัมผัสทางผิวหนังเป็นเวลานานจะขจัดไขมันตามธรรมชาติของคุณทำให้ผิวหนังอักเสบ.
- การสูดดมสามารถทำให้เกิดอาการคล้ายไข้หวัดใหญ่ (โลหะฟูม) สภาพมีไข้สูงหนาวสั่นปากแห้งและลำคอปวดกล้ามเนื้อและปวดศีรษะ.
- มันสามารถทำให้ระบบทางเดินหายใจระคายเคืองและเพิ่มอัตราการติดเชื้อทางเดินหายใจ (ปอดอักเสบ) ความเป็นพิษจากการดูดซึมเกลือแมงกานีสอนินทรีย์ผ่านปอดไม่น่าจะเกิดขึ้นได้ แต่พิษเรื้อรังสามารถเกิดขึ้นได้.
- การสัมผัสกับฝุ่นหรือควันจากแมงกานีสไดออกไซด์เรื้อรังเป็นระยะเวลานานอาจส่งผลกระทบต่อระบบประสาทส่วนกลางและนำไปสู่การพัฒนาของโรคพาร์กินสัน, ปัญหาในการเดิน, กล้ามเนื้อกระตุกและการเปลี่ยนแปลงพฤติกรรม.
- การกลืนกินอาจทำให้เกิดอาการปวดท้องและคลื่นไส้.
- ไม่ติดไฟ แต่ช่วยกระจายไฟในวัสดุยอง หากถูกความร้อนจนถึงอุณหภูมิสูงกว่า 535 ° C สารจะสลายตัวเป็นแมงกานีสออกไซด์ (III) Mn2O3 และออกซิเจนซึ่งไวไฟและเพิ่มอันตรายจากไฟไหม้ ในกรณีนี้ไฟควรดับด้วยโฟมหรือคาร์บอนไดออกไซด์.
- ในกรณีที่มีการหกอย่าใช้สารโดยไม่มีการป้องกันส่วนบุคคลที่เหมาะสม.
- เก็บสารประกอบในภาชนะที่ปิดสนิทในที่เย็นและแห้งและอยู่ห่างจากสารที่เข้ากันไม่ได้เช่นวัสดุอินทรีย์และวัสดุที่ติดไฟได้.
- ที่เก็บต้องแห้งและมีพื้นทนต่อการกัดกร่อนของกรดและมีการระบายน้ำดี.
- ควรใช้อุปกรณ์ป้องกันภัยส่วนบุคคลเช่นถุงมือแว่นตานิรภัยหน้ากากป้องกันไอฝุ่นและควัน.
การอ้างอิง
- B, (2015), แมงกานีสไดออกไซด์, ราชสมาคมเคมี - เคมีโลก, ดึงออกมาจาก chemistryworld.com
- Karal, (2014), Mangneso Dioxide, เอกสารข้อมูลความปลอดภัย, กู้คืนจาก, karal.com.mx
- ครูเสมือนของคุณ (2015/02/25) สารประกอบอนินทรีย์แมงกานีส (กรณีพิเศษ 1) - บทเรียนเชิงทฤษฎี) ที่ดึงมาจาก youtube.com
- Ecured, (s.f), แมงกานีสไดออกไซด์, ได้รับการกู้คืนจาก ecured.cu
- Angarita G, Johnny., (2017), แมงกานีสไดออกไซด์: เทคโนโลยีชั้นยอด. Hidroteco, กู้คืนจาก hydrotecocr.com
- Fernández, G. , (2015), MnO แมงกานีสไดออกไซด์2/ อะซิโตน, เคมีอินทรีย์, กู้คืนจาก quimicaorganica.net
- Tronox, (2011), แมงกานีสไดออกไซด์, เอกสารข้อมูลความปลอดภัย, กู้คืนจาก, tronox.com


