สูตรลิเธียมออกไซด์คุณสมบัติความเสี่ยงและการใช้งาน
ลิเธียมออกไซด์ เป็นสารประกอบเคมีอนินทรีย์ของสูตรลี่2หรือเกิดขึ้นพร้อมกับลิเทียมเปอร์ออกไซด์จำนวนเล็กน้อยเมื่อโลหะลิเธียมถูกเผาไหม้ในอากาศและรวมกับออกซิเจน.
จนถึงปี 1990 ตลาดโลหะและลิเธียมถูกครอบงำโดยการผลิตของสหรัฐจากแหล่งแร่ แต่ในช่วงต้นศตวรรษที่ 21 การผลิตส่วนใหญ่มาจากแหล่งที่ไม่ใช่ของสหรัฐ ออสเตรเลียชิลีและโปรตุเกสเป็นซัพพลายเออร์ที่สำคัญที่สุดในโลก โบลิเวียมีครึ่งหนึ่งของเงินฝากลิเธียมในโลก แต่ไม่ใช่ผู้ผลิตรายใหญ่.
รูปแบบการค้าที่สำคัญที่สุดคือลิเธียมคาร์บอเนต2CO3, ผลิตจากแร่ธาตุหรือน้ำเกลือโดยกระบวนการที่แตกต่างกัน.
เมื่อลิเธียมถูกเผาไหม้ในอากาศผลิตภัณฑ์หลักคือออกไซด์สีขาวของลิเธียมออกไซด์2O. นอกจากนี้ยังผลิตลิเทียมเปอร์ออกไซด์อีกด้วย2O2, ยังขาว.
นอกจากนี้ยังสามารถทำได้ผ่านการสลายตัวทางความร้อนของลิเธียมไฮดรอกไซด์ LiOH หรือลิเธียมเปอร์ออกไซด์, Li2O2
4Li + s2(g) → 2Li2(s)
2LiOH + ความร้อน→ Li2O (s) + H2O (g)
2Li2O2(s) + ความร้อน→ 2Li2O (s) + O2(G)
คุณสมบัติทางกายภาพและทางเคมี
ลิเธียมออกไซด์เป็นของแข็งสีขาวที่รู้จักกันในชื่อ lithia ที่ไม่มีกลิ่นและรสเค็ม ลักษณะที่ปรากฏอยู่ในรูปที่ 2 (ศูนย์ข้อมูลเทคโนโลยีชีวภาพแห่งชาติ 2017).

รูปที่ 2: การปรากฏตัวของลิเธียมออกไซด์
ลิเธียมออกไซด์เป็นผลึกที่มีรูปทรงแอนติคลอไรต์คล้ายกับโซเดียมคลอไรด์ (มีศูนย์กลางอยู่ที่ใบหน้า) โครงสร้างผลึกของมันถูกนำเสนอในรูปที่ 3 (Mark Winter [The University of Sheffield and WebElements Ltd, 2016].
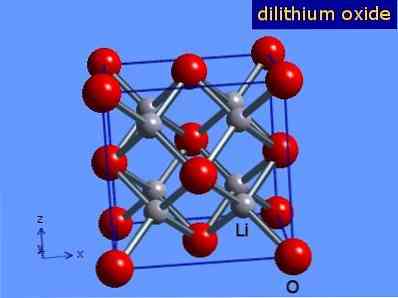
รูปที่ 3: โครงสร้างผลึกของลิเธียมออกไซด์.
น้ำหนักโมเลกุลของมันคือ 29.88 g / mol ความหนาแน่นของมันคือ 2.013 g / mL และจุดหลอมเหลวและจุดเดือดคือ 1438 ° C และ 2066 ° C ตามลำดับ สารประกอบนี้ละลายได้ดีในน้ำแอลกอฮอล์อีเธอร์ไพริดีนและไนโตรเบนซีน (ราชสมาคมเคมีปี 2558).
ลิเธียมออกไซด์ทำปฏิกิริยาง่าย ๆ กับไอน้ำในรูปแบบไฮดรอกไซด์และกับคาร์บอนไดออกไซด์ในรูปแบบคาร์บอเนต; ดังนั้นจึงต้องเก็บและจัดการในบรรยากาศที่สะอาดและแห้ง.
สารประกอบออกไซด์ไม่ก่อให้เกิดกระแสไฟฟ้า อย่างไรก็ตามออกไซด์ที่มีโครงสร้างบางชนิดของเพอร์มอฟไซท์เป็นตัวนำไฟฟ้าที่ค้นหาการประยุกต์ใช้ในแคโทดของเซลล์เชื้อเพลิงออกไซด์ของแข็งและระบบการสร้างออกซิเจน.
เป็นสารประกอบที่มีออกซิเจนไอออนอย่างน้อยหนึ่งตัวและไอออนบวกหนึ่งไอออน (American Elements, S.F. ).
ปฏิกิริยาและอันตราย
ลิเธียมออกไซด์เป็นสารประกอบที่เสถียรไม่เข้ากับกรดแก่น้ำและคาร์บอนไดออกไซด์ ตามความรู้ของเราคุณสมบัติทางเคมีกายภาพและพิษวิทยาของลิเทียมออกไซด์ยังไม่ได้รับการตรวจสอบและรายงานในเชิงลึก.
ความเป็นพิษของสารประกอบลิเธียมเป็นหน้าที่ของการละลายในน้ำ ลิเธียมไอออนมีพิษต่อระบบประสาทส่วนกลาง สารประกอบนี้มีความระคายเคืองเมื่อสัมผัสกับดวงตา, ผิวหนัง, เมื่อสูดดมหรือกลืนกิน (ESPI METALS, 1993).
ในกรณีที่สัมผัสกับดวงตาคุณควรตรวจสอบว่าคุณใส่คอนแทคเลนส์แล้วนำออกทันที ควรล้างตาด้วยน้ำไหลเป็นเวลาอย่างน้อย 15 นาทีทำให้เปลือกตาเปิด คุณสามารถใช้น้ำเย็น ครีมไม่ควรใช้กับดวงตา.
หากสารเคมีสัมผัสกับเสื้อผ้าให้ถอดออกโดยเร็วที่สุดเพื่อปกป้องมือและร่างกายของคุณ วางเหยื่อไว้ในห้องอาบน้ำที่ปลอดภัย.
หากสารเคมีสะสมบนผิวหนังที่สัมผัสของเหยื่อเช่นมือให้ค่อยๆล้างผิวหนังที่ปนเปื้อนด้วยน้ำที่ไหลและสบู่ที่ไม่ขัด คุณสามารถใช้น้ำเย็น หากยังคงมีอาการระคายเคืองให้ไปพบแพทย์ ซักเสื้อผ้าที่เปื้อนก่อนนำมาใช้ซ้ำ.
ในกรณีที่สูดหายใจเข้าไปผู้ป่วยควรได้รับอนุญาตให้พักผ่อนในบริเวณที่อากาศถ่ายเทได้ดี หากการสูดดมรุนแรงผู้ป่วยควรอพยพไปยังบริเวณปลอดภัยโดยเร็วที่สุด.
คลายเสื้อผ้าที่รัดรูปเช่นปกเสื้อเข็มขัดหรือเน็คไท หากผู้ป่วยพบว่าหายใจลำบากควรให้ออกซิเจนแก่ผู้ป่วย หากผู้ป่วยไม่หายใจการช่วยชีวิตแบบปากต่อปากจะดำเนินการ.
คำนึงถึงเสมอว่าอาจเป็นอันตรายสำหรับบุคคลที่ให้ความช่วยเหลือในการช่วยชีวิตแบบปากต่อปากเมื่อวัสดุหายใจเป็นพิษติดเชื้อหรือกัดกร่อน.
ในทุกกรณีคุณควรไปพบแพทย์ทันที (SIGMA-ALDRICH, 2010).
การใช้งาน
ลิเทียมออกไซด์ถูกใช้เป็นฟลักซ์ในเคลือบเซรามิกและสร้างสีน้ำเงินด้วยทองแดงและกุหลาบด้วยโคบอลต์ ลิเทียมออกไซด์ทำปฏิกิริยากับน้ำและไอน้ำทำให้เกิดลิเทียมไฮดรอกไซด์และต้องแยกตัวออกจากพวกมัน.
ลิเธียมออกไซด์ (Li2O) ด้วยไอโซโทปที่มีศักยภาพสูงเป็นตัวเลือกที่น่าสนใจสำหรับวัสดุเพาะเลี้ยงที่มั่นคงของโรงไฟฟ้า DT fusion เนื่องจากมีความหนาแน่นสูงของลิเธียมอะตอม (เทียบกับลิเธียมหรือลิเธียมเมทัลลิกอื่น ๆ ) ความร้อนค่อนข้างสูง (LITHIUM OXIDE (Li2O), SF).
ลี้2หรือจะสัมผัสกับอุณหภูมิสูงภายใต้การฉายรังสีนิวตรอนในระหว่างการทำงานของผ้าห่มฟิวชั่น ภายใต้สถานการณ์เหล่านี้จะมีข้อบกพร่องของการฉายรังสีจำนวนมากเกิดขึ้นในลี่2หรือเช่นบวมที่เกิดจากฮีเลียมการขยายตัวทางความร้อนค่อนข้างสูงการเจริญเติบโตของเมล็ดการก่อตัวของ LiOH (T) และการตกตะกอนที่อุณหภูมิต่ำและการขนส่งมวลของ LiOH (T) ที่อุณหภูมิสูง.
นอกจากนี้หลี่2หรืออาจเกิดจากความเครียดที่เกิดจากความแตกต่างของการขยายตัวทางความร้อนระหว่างลี่2O และวัสดุโครงสร้าง ลักษณะเหล่านี้ของลี่2หรือพวกเขานำไปสู่ปัญหาทางวิศวกรรมที่ท้าทายทั้งในการผลิตและการออกแบบผ้าห่ม.
การใช้งานใหม่ที่เป็นไปได้คือการแทนที่โคบอลต์และลิเธียมออกไซด์เป็นแคโทดในแบตเตอรี่ลิเธียมไอออนที่ใช้ในการจ่ายพลังงานให้กับอุปกรณ์อิเล็กทรอนิกส์จากโทรศัพท์มือถือไปยังแล็ปท็อปเช่นเดียวกับรถยนต์ที่ใช้พลังงานจากแบตเตอรี่.
การอ้างอิง
- Mark Winter [มหาวิทยาลัยเชฟฟิลด์และ WebElements Ltd. (2016). webelements. นำมาจาก Lithium: dilithium ออกไซด์ webelements.com.
- องค์ประกอบอเมริกัน ( S.F. ). ลิเธียมออกไซด์. นำมาจาก americanelements americanelements.com.
- โลหะ ESPI (1993 มิถุนายน). ลิเธียมออกไซด์. นำมาจาก espimetals espimetals.com.
- LITHIUM OXIDE (Li2O). ( S.F. ) นำมาจาก ferp.ucsd.edu ferp.ucsd.edu.
- ศูนย์ข้อมูลเทคโนโลยีชีวภาพแห่งชาติ. (2017, 24 มิถุนายน). PubChem ฐานข้อมูลแบบผสม; CID = 166630. นำมาจาก PubChem pubchem.ncbi.nlm.nih.gov.
- Reade International Corp. (2016). ผงลิเธียมออกไซด์ (Li2O). นำมาจาก reade reade.com
- ราชสมาคมเคมี (2015). ลิเธียมออกไซด์.นำมาจาก chemspiderchemspider.com.
- Sigma-หมวด (2010). เอกสารข้อมูลความปลอดภัยวัสดุลิเธียมออกไซด์. นำมาจาก chemblink chemblink.com.


