โครงสร้างกรด Picric การสังเคราะห์คุณสมบัติและการใช้งาน
กรด picric เป็นสารประกอบเคมีอินทรีย์ที่มีไนเตรตสูงชื่อ IUPAC คือ 2,4,6-trinitrophenol สูตรโมเลกุลของมันคือ C6H2(NO2)3OH มันเป็นกรดฟีนอลมากและสามารถพบได้เป็นโซเดียมแอมโมเนียมหรือโพแทสเซียม picrate; นั่นคือในรูปแบบไอออนิกซี6H2(NO2)3ONA.
มันเป็นรสชาติที่แข็งแกร่งของรสขมและจากชื่อนั้นมาจากคำภาษากรีก 'prikos' ซึ่งหมายถึงความขม พบว่าเป็นผลึกสีเหลืองเปียก การทำให้แห้งหรือการคายน้ำของมันเป็นอันตรายเนื่องจากมันจะเพิ่มคุณสมบัติไม่เสถียรที่ทำให้เกิดการระเบิด.
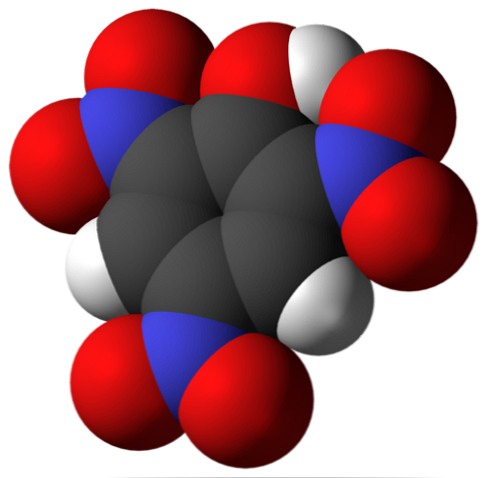
ด้านบนเป็นโมเลกุลของกรด picric ในภาพเป็นเรื่องยากที่จะจดจำพันธะและอะตอมเพราะสิ่งนี้สอดคล้องกับการเป็นตัวแทนของพื้นผิวแวนเดอร์วาวาล โครงสร้างโมเลกุลถูกกล่าวถึงอย่างละเอียดในหัวข้อถัดไป.
สารประกอบกลางบางชนิดเกลือพิเครตและสารประกอบกรดพิคริกหลากหลายชนิดถูกสังเคราะห์จากกรดพิคริก.
กรด Picric ใช้เป็นฐานสำหรับการสังเคราะห์สีย้อมสีเหลืองถาวร นักพยาธิวิทยาและนักวิจัยบางคนใช้มันในการตรึงหรือการย้อมสีของส่วนเนื้อเยื่อและกระบวนการอิมมูโนฮิสโตเคมีอื่น ๆ.
มันมีประโยชน์มากในการเตรียมผลิตภัณฑ์ยา นอกจากนี้ยังใช้ในการผลิตไม้ขีดไฟหรือไม้ขีดไฟและวัตถุระเบิด นอกจากนี้ยังใช้ในการแกะสลักโลหะทำกระจกสีและในการหาค่าพารามิเตอร์ทางชีวภาพเช่น creatinine.
ในทางกลับกันกรด picric จะระคายเคืองเมื่อสัมผัสกับผิวหนังด้วยเยื่อบุทางเดินหายใจตาและทางเดินอาหาร นอกจากจะทำร้ายผิวหนังแล้วยังส่งผลกระทบอย่างรุนแรงต่อไตเลือดและตับในอวัยวะอื่น ๆ.
ดัชนี
- 1 โครงสร้าง
- 1.1 กรดฟีนอล
- 1.2 โครงสร้างผลึก
- 2 สรุป
- 2.1 ไนเตรตโดยตรงของฟีนอล
- 3 คุณสมบัติทางกายภาพและทางเคมี
- 3.1 น้ำหนักโมเลกุล
- 3.2 ลักษณะทางกายภาพ
- 3.3 กลิ่น
- 3.4 Taste
- 3.5 จุดหลอมเหลว
- 3.6 จุดเดือด
- 3.7 ความหนาแน่น
- 3.8 การละลาย
- 3.9 การกัดกร่อน
- 3.10 pKa
- 3.11 ความไม่แน่นอน
- 4 ใช้
- 4.1 การวิจัย
- 4.2 เคมีอินทรีย์
- 4.3 ในอุตสาหกรรม
- 4.4 การใช้งานทางทหาร
- 5 ความเป็นพิษ
- 6 อ้างอิง
โครงสร้าง

ในภาพด้านบนการเชื่อมโยงทั้งหมดและโครงสร้างของโมเลกุลกรด picric จะแสดงรายละเอียดมากขึ้น มันประกอบด้วยฟีนอลที่มีสารไนโตรสามองค์ประกอบ.
จะเห็นได้ว่าในกลุ่มไม่มี2 อะตอมของไนโตรเจนมีประจุเป็นบางส่วนในเชิงบวกดังนั้นจึงต้องการความหนาแน่นทางอิเล็กทรอนิกส์ของสภาพแวดล้อม แต่วงแหวนอะโรมาติกก็ดึงดูดอิเล็กตรอนเข้าหาตัวมันเองและก่อนหน้าเลขสามตัว2 มันจบลงด้วยการยอมแพ้ส่วนหนึ่งของความหนาแน่นทางอิเล็กทรอนิกส์ของตัวเอง.
ผลที่ตามมาคือสิ่งนี้ออกซิเจนของกลุ่ม OH มีแนวโน้มที่จะแบ่งปันหนึ่งในคู่ของอิเล็กทรอนิคส์อิสระที่จะจัดหาการขาดอิเล็กทรอนิกส์ได้รับความเดือดร้อนจากแหวน; และในการทำเช่นนั้นการเชื่อมโยง C = O จะเกิดขึ้น+-H. ภาระออกซิเจนบางส่วนบางส่วนทำให้พันธะ O-H อ่อนแอและเพิ่มความเป็นกรด นั่นคือมันจะถูกปล่อยออกมาเป็นไฮโดรเจนไอออน, เอช+.
กรดฟีนอล
ด้วยเหตุนี้เองสารประกอบนี้จึงเป็นกรด (และรีแอคทีฟ) ที่ยอดเยี่ยมยิ่งกว่ากรดอะซิติกเอง อย่างไรก็ตามสารประกอบนี้เป็นฟีนอลที่มีความเป็นกรดเกินกว่าฟีนอลอื่น ๆ ครบกำหนดดังที่ได้กล่าวถึงไปยังตัวแทนย่อย NO2.
ดังนั้นเนื่องจากเป็นฟีนอลกลุ่ม OH จึงมีความสำคัญและชี้นำการแจงนับในโครงสร้าง สาม NO2 พวกเขาอยู่ใน carbons 2, 4 และ 6 ของ aromatic ring ที่เกี่ยวกับ OH ดังนั้นศัพท์เฉพาะของ IUPAC สำหรับสารประกอบนี้: 2,4,6-Trinitrophenol (TNP สำหรับคำย่อในภาษาอังกฤษ).
ถ้ากลุ่มไม่ได้2, หรือถ้ามีจำนวนน้อยลงในวงแหวนพันธะ O-H จะอ่อนตัวลงน้อยลงดังนั้นสารประกอบจะมีความเป็นกรดต่ำกว่า.
โครงสร้างผลึก
โมเลกุลของกรดปิคริกถูกจัดเรียงในลักษณะที่ให้ประโยชน์แก่ปฏิกิริยาระหว่างโมเลกุลของพวกมัน ทั้งสำหรับการก่อตัวของสะพานไฮโดรเจนระหว่างกลุ่ม OH และ NO2, แรงไดโพล - ไดโพลหรือแรงผลักไฟฟ้าสถิตระหว่างพื้นที่ขาดอิเล็กตรอน.
อาจเป็นไปได้ว่ากลุ่มทำไม่ได้2 พวกเขากันและจะมุ่งเน้นไปที่วงอะโรเมติกใกล้เคียง นอกจากนี้ยังไม่สามารถปรับวงแหวนให้อยู่ด้านบนของกันและกันโดยการเพิ่มแรงขับไฟฟ้าสถิต.
ผลิตภัณฑ์ของปฏิกิริยาทั้งหมดเหล่านี้กรด picric จัดการเพื่อสร้างเครือข่ายสามมิติที่กำหนดคริสตัล; ซึ่งเซลล์หน่วยสอดคล้องกับระบบคริสตัลประเภท orthorhombic.
การสังเคราะห์
เริ่มแรกถูกสังเคราะห์จากสารประกอบธรรมชาติเช่นอนุพันธ์ของฮอร์นสัตว์เรซินธรรมชาติและอื่น ๆ ตั้งแต่ปี 1841 ฟีนอลถูกใช้เป็นสารตั้งต้นของกรด picric ตามเส้นทางหลายเส้นทางหรือผ่านกระบวนการทางเคมีที่หลากหลาย.
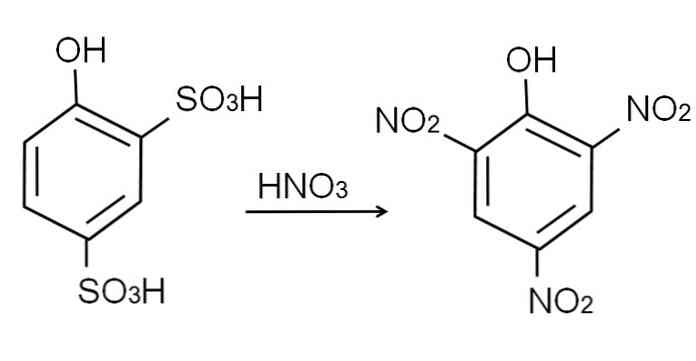
อย่างที่ได้กล่าวไปแล้วมันเป็นหนึ่งในฟีนอลที่เป็นกรดมากที่สุด ในการสังเคราะห์มันเป็นสิ่งจำเป็นครั้งแรกที่ฟีนอลต้องผ่านกระบวนการซัลโฟเนชั่นตามด้วยกระบวนการไนเตรต.
ซัลโฟเนชั่นของฟีนอลรัสจะดำเนินการโดยการรักษาฟีนอลด้วยกรดซัลฟูริกควันด้วยการแทนที่ electrophilic อะโรมาติกของ H โดยกลุ่มซัลโฟ3H ในตำแหน่ง -ort และ - สำหรับกลุ่ม OH.
สำหรับผลิตภัณฑ์นี้กรด 2,4-fenoldisulfonic กระบวนการไนเตรตจะดำเนินการโดยใช้กรดไนตริกเข้มข้น ในการทำเช่นนั้นกลุ่ม SO ทั้งสองกลุ่ม3H ถูกแทนที่ด้วยกลุ่ม nitro, NO2, และหนึ่งในสามเข้าสู่ตำแหน่งอื่น ๆ ของไนโตร สมการทางเคมีต่อไปนี้แสดงให้เห็นถึงสิ่งนี้:
ไนเตรตโดยตรงของฟีนอล
กระบวนการไนเตรตของฟีนอลไม่สามารถทำได้โดยตรงเนื่องจากมีการสร้างน้ำหนักโมเลกุลสูง วิธีการสังเคราะห์นี้ต้องการการควบคุมอุณหภูมิอย่างระมัดระวังเนื่องจากเป็นคายความร้อน:
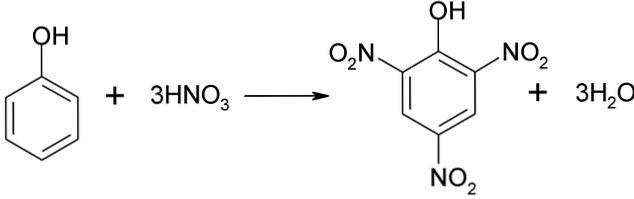
กรด Picric สามารถรับได้โดยการทำกระบวนการไนเตรตโดยตรงของ 2,4-dinitrophenol ด้วยกรดไนตริก.
การสังเคราะห์อีกรูปแบบหนึ่งคือการรักษาเบนซีนด้วยกรดไนตริกและไนเตรทเมอคิวริก.
คุณสมบัติทางกายภาพและทางเคมี
น้ำหนักโมเลกุล
229.104 g / mol.
ลักษณะทางกายภาพ
การแขวนลอยของมวลหรือสีเหลืองของผลึกที่เปียก.
กลิ่น
มันไม่มีกลิ่น.
รสชาติ
มันมีรสขมมาก.
จุดหลอมเหลว
122.5 ° C.
จุดเดือด
300 ° C แต่เมื่อมันละลายมันจะระเบิด.
ความหนาแน่น
1.77 g / mL.
สามารถในการละลาย
มันเป็นสารประกอบที่ละลายในน้ำปานกลาง นี่เป็นเพราะกลุ่ม OH และ NO ของพวกเขา2 พวกมันสามารถโต้ตอบกับโมเลกุลของน้ำผ่านพันธะไฮโดรเจน แม้ว่าวงแหวนอะโรมาติกจะไม่ชอบน้ำและการละลายของมันก็จะลดลง.
กัดกร่อน
กรดพิคริกกัดกร่อนโดยทั่วไปกับโลหะยกเว้นดีบุกและอลูมิเนียม.
pKa
0.38 มันเป็นกรดอินทรีย์ที่แข็งแกร่ง.
ความไม่แน่นอน
กรด Picric มีคุณสมบัติไม่เสถียร มันมีความเสี่ยงต่อสภาพแวดล้อมมันไม่มั่นคงระเบิดและเป็นพิษ.
ควรเก็บไว้ในที่ปิดสนิทเพื่อหลีกเลี่ยงการขาดน้ำเนื่องจากกรด picric จะระเบิดได้มากหากปล่อยให้แห้ง เราจะต้องระมัดระวังอย่างมากกับรูปแบบที่ปราศจากเพราะมันมีความไวต่อแรงเสียดทานแรงกระแทกและความร้อน.
กรด Picric ควรเก็บไว้ในที่มีอากาศถ่ายเทเย็นและห่างจากวัสดุที่สามารถออกซิไดซ์ได้ ระคายเคืองต่อผิวหนังและเยื่อเมือกไม่ควรกลืนและเป็นพิษต่อร่างกาย.
การใช้งาน
กรด Picric ถูกนำมาใช้กันอย่างแพร่หลายในการวิจัยเคมีอุตสาหกรรมและการทหาร.
การวิจัย
เมื่อใช้เป็นตัวตรึงเซลล์และเนื้อเยื่อมันจะปรับปรุงผลลัพธ์ของสีเหล่านี้ด้วยสีย้อมที่เป็นกรด มันเกิดขึ้นกับวิธีการระบายสี trichrome หลังจากตรึงเนื้อเยื่อด้วยฟอร์มาลินแนะนำให้ใช้การตรึงใหม่ด้วยกรด picric.
ด้วยวิธีนี้รับประกันว่าสีของเนื้อเยื่อจะเข้มและสว่างมาก ไม่ได้ผลลัพธ์ที่ดีเมื่อใช้สีย้อมพื้นฐาน อย่างไรก็ตามควรใช้ความระมัดระวังเนื่องจากกรด picric สามารถไฮโดรไลซ์ DNA ได้หากเหลือเวลามากเกินไป.
เคมีอินทรีย์
-ในเคมีอินทรีย์มันถูกใช้เป็นด่าง picrates เพื่อดำเนินการระบุและวิเคราะห์สารต่าง ๆ.
-มันถูกใช้ในการวิเคราะห์ทางเคมีของโลหะ.
-ในห้องปฏิบัติการทางคลินิกใช้ในการกำหนดระดับเซรั่มและ creatinine ในปัสสาวะ.
-มันยังถูกใช้ในรีเอเจนต์บางตัวที่ใช้สำหรับการวิเคราะห์ระดับกลูโคส.
ในอุตสาหกรรม
-ในระดับของอุตสาหกรรมการถ่ายภาพกรดพิคริกถูกใช้เป็นสารชำระล้างในอิมัลชั่นถ่ายภาพ มันเป็นส่วนหนึ่งของการพัฒนาผลิตภัณฑ์เช่นยาฆ่าแมลงยาฆ่าแมลงที่แข็งแกร่งเป็นต้น.
-กรด Picric ใช้ในการสังเคราะห์สารประกอบทางเคมีระดับกลางอื่น ๆ เช่น chloropicrin และ picramic acid เป็นต้น ยาและสีย้อมบางชนิดสำหรับอุตสาหกรรมเครื่องหนังได้รับการพัฒนาจากสารประกอบเหล่านี้.
-กรด Picric มาเพื่อใช้ในการรักษาแผลไฟไหม้ในฐานะที่เป็นน้ำยาฆ่าเชื้อและเงื่อนไขอื่น ๆ ก่อนที่ความเป็นพิษของมันเป็นหลักฐาน.
-ส่วนประกอบที่สำคัญเนื่องจากลักษณะการระเบิดในการผลิตไม้ขีดไฟและแบตเตอรี่.
การใช้งานทางทหาร
-เนื่องจากมีกรด picric ที่ระเบิดได้สูงจึงถูกนำไปใช้ในโรงงานผลิตอาวุธยุทโธปกรณ์.
-กรด picric ที่ถูกกดและละลายถูกนำมาใช้ในกระสุนปืนใหญ่ระเบิดลูกระเบิดและเหมือง.
-เกลือแอมโมเนียมของกรด picric ถูกใช้เป็นวัตถุระเบิดมันมีประสิทธิภาพมาก แต่มีความเสถียรน้อยกว่า TNT ครั้งหนึ่งมันถูกใช้เป็นส่วนประกอบของเชื้อเพลิงจรวด.
ความเป็นพิษ
มันได้รับการพิสูจน์แล้วว่าเป็นพิษต่อร่างกายมนุษย์และโดยทั่วไปต่อสิ่งมีชีวิตทั้งหมด.
แนะนำให้หลีกเลี่ยงการสูดดมและกลืนกินเนื่องจากความเป็นพิษทางปากเฉียบพลัน นอกจากนี้ยังทำให้เกิดการกลายพันธุ์ในจุลินทรีย์ นำเสนอความเป็นพิษต่อสัตว์ป่าสัตว์เลี้ยงลูกด้วยนมและโดยทั่วไปในสิ่งแวดล้อม.
การอ้างอิง
- Graham Solomons T.W. , Craig B. Fryhle (2011) เคมีอินทรีย์ เอมีน (10TH ฉบับที่.) ไวลีย์พลัส.
- Carey F. (2008) เคมีอินทรีย์ (ฉบับที่หก) Mc Graw Hill.
- วิกิพีเดีย (2018) กรด Picric สืบค้นจาก: en.wikipedia.org
- มหาวิทยาลัยเพอร์ดู (2004) การระเบิดของกรด Picric สืบค้นจาก: chemed.chem.purdue.edu
- โครงการ Crystallography 365 (10 กุมภาพันธ์ 2014) น้อยกว่าสีเหลืองอ่อน - โครงสร้างของกรด picric ดึงมาจาก: crystallography365.wordpress.com
- PubChem (2019) กรด Picric สืบค้นจาก: pubchem.ncbi.nlm.nih.gov
- คนทำขนมปัง, J. R. (1958) กรด Picric เมทูเอนลอนดอนสหราชอาณาจักร.


