โครงสร้างไซโคลเฮกซีนคุณสมบัติการสังเคราะห์และการใช้งาน
cyclohexene เป็นอัลคีนหรือโอเลฟินซึ่งมีสูตรโมเลกุลคือ C6H10. ประกอบด้วยของเหลวไม่มีสีละลายในน้ำและละลายได้กับตัวทำละลายอินทรีย์หลายชนิด มันเป็นลักษณะของการติดไฟและในธรรมชาติมักจะพบในน้ำมันถ่านหิน.
ไซโคลเฮกซีนถูกสังเคราะห์โดยไฮโดรจีเนชันบางส่วนของเบนซีนและโดยการคายน้ำของไซโคลเฮกซีนแอลกอฮอล์ นั่นคือรูปแบบที่เป็นสนิมมากขึ้น เช่นเดียวกับ cycloalkenes อื่น ๆ มันผ่านปฏิกิริยาของการเติมอิเล็กโทรไลต์และอนุมูลอิสระ; ตัวอย่างเช่นปฏิกิริยาฮาโลเจน.
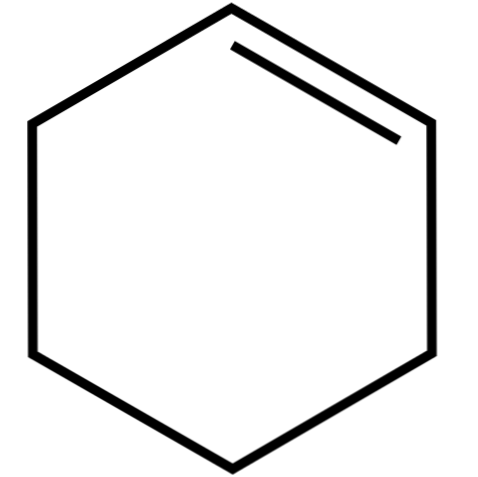
อัลคินวัฏจักร (ภาพบนสุด) นี้เป็นส่วนผสมของ azeotropic (ไม่สามารถแยกได้จากการกลั่น) โดยมีแอลกอฮอล์ต่ำและกรดอะซิติก มันไม่ได้มีเสถียรภาพมากในการจัดเก็บเป็นเวลานานเนื่องจากมันสลายตัวภายใต้การกระทำของแสงแดดและรังสีอัลตราไวโอเลต.
ไซโคลเฮกซีนถูกนำมาใช้เป็นตัวทำละลายดังนั้นจึงมีการใช้งานมากมายเช่น: ความคงตัวของก๊าซออกเทนสูงและสำหรับการสกัดน้ำมัน.
แต่สิ่งที่สำคัญที่สุดคือไซโคลเฮกซีนทำหน้าที่เป็นสื่อกลางและวัตถุดิบสำหรับการผลิตสารประกอบที่มีประโยชน์มากมายในหมู่พวกเขา: ไซโคลเฮกซานีน, กรด adipic, กรดมาลิก, ไซโคลเฮกเซน, butadiene,.
ดัชนี
- 1 โครงสร้างของไซโคลเฮกซีน
- 1.1 ปฏิสัมพันธ์ระหว่างโมเลกุล
- 2 คุณสมบัติ
- 2.1 ชื่อทางเคมี
- 2.2 น้ำหนักโมเลกุล
- 2.3 ลักษณะทางกายภาพ
- 2.4 กลิ่น
- 2.5 จุดเดือด
- 2.6 จุดหลอมเหลว
- 2.7 จุดวาบไฟ
- 2.8 การละลายในน้ำ
- 2.9 การละลายในตัวทำละลายอินทรีย์
- 2.10 ความหนาแน่น
- 2.11 ความหนาแน่นไอ
- 2.12 ความดันไอ
- 2.13 การจุดระเบิดอัตโนมัติ
- 2.14 การสลายตัว
- 2.15 ความหนืด
- 2.16 ความร้อนจากการเผาไหม้
- 2.17 การระเหยของความร้อน
- 2.18 แรงตึงผิว
- 2.19 พอลิเมอไรเซชัน
- 2.20 เกณฑ์กลิ่น
- 2.21 ดัชนีการหักเหของแสง
- 2.22 pH
- 2.23 ความเสถียร
- 2.24 ปฏิกิริยา
- 3 สรุป
- 4 ใช้
- 5 ความเสี่ยง
- 6 อ้างอิง
โครงสร้างของไซโคลเฮกซีน
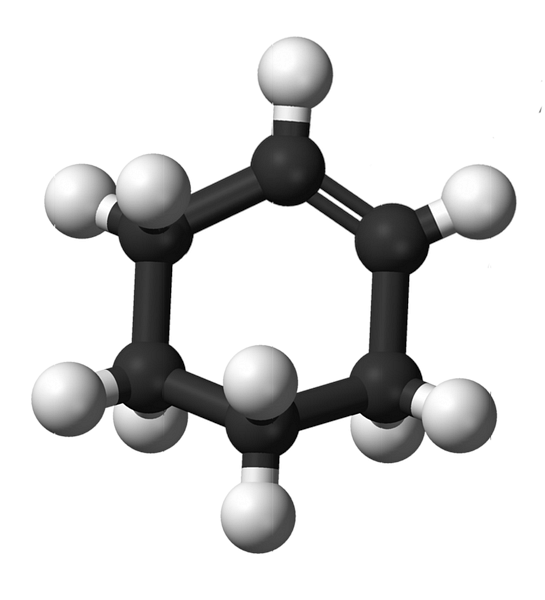
โครงสร้างของไซโคลเฮกซีนที่มีรูปแบบของทรงกลมและแท่งแสดงในภาพด้านบน หนึ่งสามารถสังเกตเห็นแหวนคาร์บอนหกและพันธะคู่ทั้งความไม่แน่นอนของสารประกอบ จากมุมมองนี้ดูเหมือนว่าแหวนจะแบน แต่มันไม่ได้ทั้งหมด.
สำหรับ starters นั้นคาร์บอนของพันธะคู่จะมี sp hybridization2, ซึ่งทำให้พวกเขาเป็นเรขาคณิตระนาบตรีโกณมิติ ดังนั้นคาร์บอนทั้งสองนี้และที่อยู่ติดกับพวกมันจึงอยู่ในระนาบเดียวกัน ในขณะที่ทั้งสอง carbons ที่ปลายตรงข้าม (ถึงพันธะคู่) อยู่เหนือและใต้เครื่องบินกล่าว.
ภาพด้านล่างแสดงให้เห็นอย่างสมบูรณ์แบบถึงสิ่งที่เพิ่งอธิบาย.

โปรดทราบว่าแถบสีดำประกอบด้วยคาร์บอนสี่ตัวนั่นคือพันธะคู่และอีกอันอยู่ติดกัน มุมมองที่เปิดเผยเป็นสิ่งที่จะได้รับหากผู้ชมวางตาของเขาไว้ด้านหน้าของพันธะคู่ จะเห็นได้ว่าคาร์บอนอยู่เหนือและใต้ระนาบนี้.
เนื่องจากโมเลกุลของไซโคลเฮกซีนไม่คงที่คาร์บอนทั้งสองจะแลกเปลี่ยนกัน: อันหนึ่งจะลดลงในขณะที่อีกโมเลกุลหนึ่งจะขึ้นเหนือระนาบ ดังนั้นคุณคาดหวังว่าโมเลกุลนั้นจะมีพฤติกรรม.
ปฏิสัมพันธ์ระหว่างโมเลกุล
ไซโคลเฮกซีนเป็นไฮโดรคาร์บอนดังนั้นปฏิสัมพันธ์ระหว่างโมเลกุลจึงขึ้นอยู่กับแรงการกระจายตัวของลอนดอน.
นี่เป็นเพราะโมเลกุลนั้นเป็น apolar โดยไม่มีช่วงไดโพลถาวรและน้ำหนักโมเลกุลของมันคือปัจจัยที่มีส่วนช่วยในการทำให้มันเกาะติดกันในของเหลว.
นอกจากนี้พันธะคู่จะเพิ่มระดับของการมีปฏิสัมพันธ์เนื่องจากมันไม่สามารถเคลื่อนที่ด้วยความยืดหยุ่นเช่นเดียวกับของคาร์บอนอื่น ๆ และสิ่งนี้ก็ช่วยให้เกิดการปฏิสัมพันธ์ระหว่างโมเลกุลที่อยู่ใกล้เคียง ด้วยเหตุนี้ไซโคลเฮกซีนจึงมีจุดเดือดสูงกว่าเล็กน้อย (83 ° C) มากกว่าไซโคลเฮกเซน (81 ° C).
สรรพคุณ
ชื่อทางเคมี
ไซโคลเฮกซีน, เตตระไฮโดรเบนซีน.
น้ำหนักโมเลกุล
82,146 กรัม / โมล.
ลักษณะทางกายภาพ
ของเหลวไม่มีสี.
กลิ่น
กลิ่นหอม.
จุดเดือด
83 ºCถึง 760 mmHg.
จุดหลอมเหลว
-103.5 ºC.
จุดติดไฟ
-7ºC (ถ้วยปิด).
การละลายในน้ำ
ไม่ละลายในน้ำตามจริง (213 mg / L).
การละลายในตัวทำละลายอินทรีย์
สามารถผสมกับเอทานอลเบนซีนคาร์บอนเตตระคลอไรด์อีเทอร์ปิโตรเลียมและอะซิโตน คาดว่ามันจะสามารถละลายสารประกอบ apolar เช่นเดียวกับ allotropes ของถ่านหิน.
ความหนาแน่น
0.810 g / cm3 ที่20ºC.
ความหนาแน่นของไอ
2.8 (สัมพันธ์กับอากาศที่ถ่ายเท่ากับ 1).
แรงดันไอน้ำ
89 mmHg ที่25ºC.
การเผาไหม้ตัวเอง
244 ºC.
การจำแนก
สลายตัวในที่ที่มีเกลือของยูเรเนียมภายใต้การกระทำของแสงแดดและรังสีอัลตราไวโอเลต.
ความเหนียว
0.625 mPascal ที่ 25 ºC.
ความร้อนจากการเผาไหม้
3,751.7 kJ / mol ที่25ºC.
ความร้อนจากการระเหย
30.46 kJ / mol ที่ 25 ºC.
แรงตึงผิว
26.26 mN / m.
พอลิเมอ
มันสามารถรวมตัวภายใต้เงื่อนไขบางประการ.
เกณฑ์กลิ่น
0.6 มก. / ม3.
ดัชนีหักเห
1.4465 ที่ 20 ºC.
พีเอช
7-8 ที่20ºC.
ความมั่นคง
ไซโคลเฮกซีนไม่เสถียรมากในระหว่างการเก็บรักษาในระยะยาว การสัมผัสกับแสงและอากาศสามารถทำให้เกิดการผลิตเปอร์ออกไซด์ ในทำนองเดียวกันมันไม่เข้ากันกับสารออกซิไดซ์ที่แรง.
ปฏิกิริยา
-ไซโคลอัลคีเนสส่วนใหญ่มีปฏิกิริยาต่อการเพิ่มทั้งอิเล็กโทรไลต์และอนุมูลอิสระ.
-ทำปฏิกิริยากับโบรมีนในรูปแบบ 1,2-dibromocyclohexane.
-ออกซิไดซ์อย่างรวดเร็วในที่ที่มีโพแทสเซียมเปอร์แมงกาเนต (KMnO)4).
-มันมีความสามารถในการผลิตอีพอกไซด์ (ไซโคลเฮกซีนออกไซด์) ต่อหน้ากรดเพอรอกซี่เบนโซอิก.
การสังเคราะห์
ไซโคลเฮกซีนผลิตโดยการเร่งปฏิกิริยากรดของไซโคลเฮกซีน:
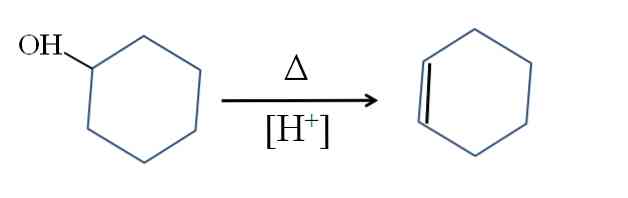
สัญลักษณ์Δแสดงถึงความร้อนที่จำเป็นในการส่งเสริมการออกจากกลุ่ม OH เป็นโมเลกุลของน้ำในสื่อที่เป็นกรด (-OH2+).
ไซโคลเฮกซีนยังผลิตโดยไฮโดรจีเนชันบางส่วนของเบนซีน นั่นคือสองพันธะคู่เพิ่มโมเลกุลไฮโดรเจน:
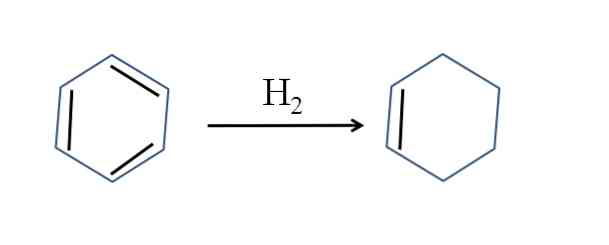
แม้ว่าปฏิกิริยาจะดูง่าย แต่ก็ต้องใช้แรงกดดันอย่างมาก2 และตัวเร่งปฏิกิริยา.
การใช้งาน
-มันมีประโยชน์เป็นตัวทำละลายอินทรีย์ นอกจากนี้ยังเป็นวัตถุดิบในการผลิตกรด adipic, adipic aldehyde, กรด maleic, cyclohexane และ cyclohexylcarboxylic acid.
-มันถูกใช้ในการผลิตไซโคลเฮกเซนคลอไรด์ซึ่งเป็นสารประกอบที่ใช้เป็นตัวกลางในการผลิตผลิตภัณฑ์ยาและสารเติมแต่งยาง.
-ไซโคลเฮกซีนยังใช้ในการสังเคราะห์ไซโคลเฮกซานีนซึ่งเป็นวัตถุดิบในการผลิตยายาฆ่าแมลงน้ำหอมและสีย้อม.
-ไซโคลเฮกซีนมีส่วนเกี่ยวข้องในการสังเคราะห์ aminocyclohexanol ซึ่งเป็นสารประกอบที่ใช้เป็นสารลดแรงตึงผิวและอิมัลซิไฟเออร์.
-นอกจากนี้ไซโคลเฮกซีนสามารถใช้ในการเตรียมในห้องปฏิบัติการบิวทาไดอีนได้ สารประกอบหลังถูกใช้ในการผลิตยางสังเคราะห์ในการผลิตยางรถยนต์และยังใช้ในการผลิตพลาสติกอะคริลิก.
-ไซโคลเฮกซีนเป็นวัตถุดิบสำหรับการสังเคราะห์ไลซีน, ฟีนอล, โพลีไซโคลโอเลฟินเรซินและสารเติมแต่งยาง.
-มันถูกใช้เป็นโคลงของก๊าซออกเทนสูง.
-เกี่ยวข้องกับการสังเคราะห์สารเคลือบกันน้ำฟิล์มกันรอยแตกและสารยึดเกาะสำหรับการเคลือบ.
ความเสี่ยง
ไซโคลเฮกซีนไม่ได้เป็นสารพิษมาก แต่สามารถทำให้ผิวหนังและตาเกิดการแดง การสูดดมสามารถทำให้เกิดอาการไอและง่วงนอน นอกจากนี้การกลืนกินอาจทำให้เกิดอาการง่วงนอนหายใจลำบากและคลื่นไส้.
ไซโคลเฮกซีนถูกดูดซึมได้ไม่ดีในระบบทางเดินอาหารดังนั้นจึงไม่คาดว่าจะมีผลกระทบที่เป็นระบบอย่างรุนแรงจากการกลืนกิน ภาวะแทรกซ้อนที่ยิ่งใหญ่ที่สุดคือความทะเยอทะยานของมันโดยระบบทางเดินหายใจซึ่งสามารถผลิตโรคปอดบวมเคมี.
การอ้างอิง
- โจเซฟเอฟเชียงและไซมอนฮาร์วีย์บาวเออร์ (1968) โครงสร้างโมเลกุลของไซโคลเฮกซีน. J. Am. Chem Soc. 1969, 91, 8, 1898-1901.
- Karry Barnes (2019) ไซโคลเฮกซีน: อันตรายการสังเคราะห์และโครงสร้าง การศึกษา ดึงมาจาก: study.com
- Morrison, R. T. และ Boyd, R. N. (1987) เคมีอินทรีย์ (5ขอบคุณ ฉบับ.) กองบรรณาธิการ Addison-Wesley Iberoamericana.
- PubChem (2019) cyclohexene สืบค้นจาก: pubchem.ncbi.nlm.nih.gov
- หนังสือเคมี (2019) cyclohexene ดึงมาจาก: chemicalbook.com
- เครือข่ายข้อมูลพิษวิทยา (2017) cyclohexene TOXNET ดึงมาจาก: toxnet.nlm.nih.gov
- Chemoxy ( N.d. ) สูตรโครงสร้างสำหรับไซโคลเฮกซีนคือ ดึงมาจาก: chemoxy.com


