คีโตนประเภทคุณสมบัติศัพท์การใช้และตัวอย่าง
คีโตน พวกเขาเป็นสารประกอบอินทรีย์ที่มีกลุ่มคาร์บอนิล (-CO) พวกเขาเป็นสารประกอบอย่างง่ายที่คาร์บอนของกลุ่มคาร์บอนิลถูกผูกมัดกับสองอะตอมคาร์บอน (และโซ่ substituent ของพวกเขา) คีโตนนั้น "ง่าย" เพราะพวกมันไม่มีกลุ่มปฏิกิริยาเช่น -OH หรือ -Cl ที่ติดอยู่กับคาร์บอน.
ในที่สุดการกำจัดคีโตนจากร่างกายมนุษย์มักจะเกี่ยวข้องกับระดับน้ำตาลในระดับต่ำ (ในกรณีผู้ป่วยโรคเบาหวานและ / หรือการอดอาหารมาก) ซึ่งอาจทำให้เกิดปัญหาสุขภาพที่รุนแรงสำหรับผู้ป่วย.
ดัชนี
- 1 สูตรทั่วไปของคีโตน
- คีโตน 2 ชนิด
- 2.1 ตามโครงสร้างของห่วงโซ่ของคุณ
- 2.2 ตามสัดส่วนของอนุมูลอิสระ
- 2.3 ตามความอิ่มตัวของสารอนุมูลอิสระ
- 2.4 Dicetones
- 3 สมบัติทางกายภาพและเคมีของคีโตน
- 3.1 จุดเดือด
- 3.2 การละลาย
- 3.3 ความเป็นกรด
- 3.4 การเกิดปฏิกิริยา
- 4 ศัพท์
- 5 ความแตกต่างระหว่างอัลดีไฮด์และคีโตน
- 6 ใช้ในอุตสาหกรรมและชีวิตประจำวัน
- 7 ตัวอย่างของคีโตน
- 7.1 Butanone (C4H8O)
- 7.2 Cyclohexanone (C6H10O)
- 7.3 ฮอร์โมนเพศชาย (C19H22O2)
- 7.4 Progesterone (C21H30O2)
- 8 อ้างอิง
สูตรทั่วไปของคีโตน
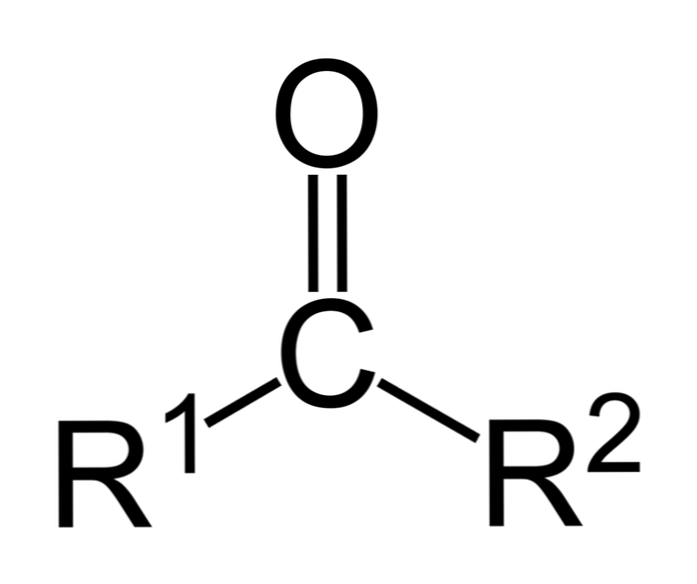
คีโตนเป็นสารประกอบคาร์บอนิลที่กลุ่มนี้ถูกผูกไว้กับกลุ่มไฮโดรคาร์บอนสองกลุ่ม เหล่านี้อาจเป็นกลุ่มอัลคิลกลุ่มแหวนเบนซินหรือทั้งสองอย่าง.
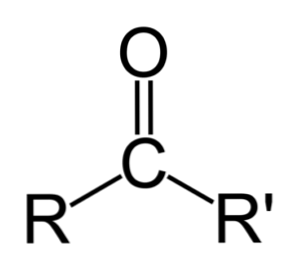
คีโตนสามารถแสดงเป็น R- (C = O) -R 'โดยที่ R และ R' เป็นโซ่ไฮโดรคาร์บอนสองอัน (อัลเคน, อัลเคน, อัลคีน, อัลคิน, ไซโคลอัลคานีน, อนุพันธ์ของเบนซีนและอื่น ๆ ) ไม่มีคีโตนที่มีไฮโดรเจนติดอยู่กับกลุ่มคาร์บอนิล.
มีวิธีการที่หลากหลายในการเตรียมคีโตนในสภาพแวดล้อมอุตสาหกรรมและห้องปฏิบัติการ นอกจากนี้สิ่งสำคัญคือต้องทราบว่าคีโตนสามารถสังเคราะห์โดยสิ่งมีชีวิตที่แตกต่างกันรวมถึงมนุษย์.
ในอุตสาหกรรมวิธีการที่ใช้กันมากที่สุดสำหรับการสังเคราะห์คีโตนนั้นเกี่ยวข้องกับการออกซิเดชั่นของไฮโดรคาร์บอนโดยทั่วไปจะใช้กับอากาศ ในขนาดเล็กคีโตนมักจะเตรียมผ่านการเกิดออกซิเดชันของแอลกอฮอล์ที่สองซึ่งทำให้ผลิตภัณฑ์เป็นคีโตนและน้ำ.
นอกเหนือจากวิธีการทั่วไปเหล่านี้คีโตนสามารถสังเคราะห์ผ่านอัลคีนอัลคิเนสเกลือของสารประกอบไนโตรเจนเอสเทอร์และสารประกอบอื่น ๆ อีกมากมายซึ่งทำให้ง่ายต่อการได้รับ.
ประเภทของคีโตน
มีหลายประเภทสำหรับคีโตนขึ้นอยู่กับองค์ประกอบย่อยในสายโซ่อาร์ของพวกเขาต่อไปนี้คือการจำแนกประเภทที่พบมากที่สุดสำหรับสารเหล่านี้:
ตามโครงสร้างของห่วงโซ่ของคุณ
ในกรณีนี้คีโตนได้รับการจำแนกตามวิธีการที่มีโครงสร้างเป็นโซ่: คีโตนอะลิฟาติกเป็นกลุ่มที่มีสองอนุมูล R และ R 'ที่มีรูปแบบของอนุมูลอัลคิล (alkanes, alkenes, alkynes และ cycloalkanes).
สำหรับส่วนของอะโรเมติกส์นั้นเป็นอนุพันธ์ของเบนซีนในขณะที่ยังคงเป็นคีโตน ในที่สุดคีโตนที่ผสมกันก็คือกลุ่มที่มี R alkyl radical และ R 'aryl radical หรือในทางกลับกัน.
ตามสัดส่วนของอนุมูลอิสระ
ในกรณีนี้อนุมูลอิสระ R และ R 'ของกลุ่มคาร์บอนิลถูกศึกษา; เมื่อสิ่งเหล่านี้เท่ากัน (เหมือนกัน) คีโตนจะถูกเรียกว่าสมมาตร แต่เมื่อมันแตกต่างกัน (เหมือนกับคีโตนส่วนใหญ่) สิ่งนี้เรียกว่าไม่สมมาตร.
ตามความอิ่มตัวของอนุมูลอิสระ
คีโตนสามารถจำแนกได้ตามความอิ่มตัวของโซ่คาร์บอน ถ้าสิ่งเหล่านี้อยู่ในรูปของอัลเคนคีโตนจะถูกเรียกว่าคีโตนอิ่มตัว ในทางตรงกันข้ามถ้าโซ่ถูกพบว่าเป็นอัลคีนหรืออัลคีเนสคีโตนจะถูกเรียกว่าคีโตนไม่อิ่มตัว.
diketones
นี่เป็นคลาสแยกต่างหากของคีโตนเนื่องจากโซ่ของคีโตนนี้มีกลุ่มคาร์บอนิลสองกลุ่มในโครงสร้าง คีโตนเหล่านี้บางอย่างมีลักษณะเฉพาะเช่นความยาวพันธะที่ยาวขึ้นระหว่างคาร์บอน.
ตัวอย่างเช่น diketones ที่ได้จาก cyclohexane เป็นที่รู้จักกันในชื่อ quinones ซึ่งมีเพียงสอง: ortho-benzoquinone และ para-benzoquinone.
สมบัติทางกายภาพและเคมีของคีโตน
คีโตนเหมือนอัลดีไฮด์ส่วนใหญ่เป็นโมเลกุลของของเหลวและมีคุณสมบัติทางกายภาพและทางเคมีหลายแบบที่แตกต่างกันไปตามความยาวของโซ่ คุณสมบัติของมันอธิบายไว้ด้านล่าง:
จุดเดือด
คีโตนมีความผันผวนสูงมีขั้วสูงและไม่สามารถบริจาคไฮโดรเจนสำหรับพันธะไฮโดรเจนได้ (พวกเขาไม่มีอะตอมไฮโดรเจนติดอยู่กับกลุ่มคาร์บอนิล) ดังนั้นพวกเขาจึงมีจุดเดือดสูงกว่าแอลคีนและอีเทอร์ แต่ต่ำกว่า แอลกอฮอล์ที่มีน้ำหนักโมเลกุลเท่ากัน.
จุดเดือดของคีโตนเพิ่มขึ้นเมื่อขนาดของโมเลกุลเพิ่มขึ้น นี่เป็นเพราะการแทรกแซงของกองกำลังแวนเดอร์วาลส์และกองกำลังไดโพล - ไดโพลซึ่งต้องการพลังงานจำนวนมากเพื่อแยกอะตอมและอิเล็กตรอนที่ดึงดูดกับโมเลกุลออกมา.
สามารถในการละลาย
ความสามารถในการละลายของคีโตนมีอิทธิพลอย่างมากต่อความสามารถของโมเลกุลเหล่านี้ในการรับไฮโดรเจนในอะตอมออกซิเจนและก่อให้เกิดพันธะไฮโดรเจนกับน้ำ นอกจากนี้แรงดึงดูดที่น่าสนใจกระจัดกระจายและไดโพล - ไดโพลเกิดขึ้นระหว่างคีโตนกับน้ำซึ่งเพิ่มผลที่ละลายน้ำได้.
คีโตนสูญเสียความสามารถในการละลายได้ยิ่งโมเลกุลของพวกเขามีขนาดใหญ่ขึ้นเมื่อพวกเขาเริ่มที่จะต้องใช้พลังงานมากขึ้นในการละลายในน้ำ พวกเขายังละลายได้ในสารประกอบอินทรีย์.
ความเปรี้ยว
ต้องขอบคุณกลุ่มคาร์บอนิลเนื่องจากคีโตนมีลักษณะเป็นกรด สิ่งนี้เกิดขึ้นเนื่องจากความสามารถในการทำให้เสถียรของการสั่นพ้องของกลุ่มการทำงานนี้ซึ่งสามารถถ่ายโอนโปรตอนจากพันธะคู่ของมันเพื่อสร้างฐานคอนจูเกตที่เรียกว่า enol.
การเกิดปฏิกิริยา
คีโตนเป็นส่วนหนึ่งของปฏิกิริยาอินทรีย์จำนวนมาก สิ่งนี้เกิดขึ้นเนื่องจากความไวของคาร์บอนิลคาร์บอนต่อการเกิดนิวคลีโอฟิลิกนอกเหนือจากขั้วของสิ่งนี้.
ดังที่ได้กล่าวไว้ข้างต้นการเกิดปฏิกิริยาสูงของคีโตนทำให้พวกมันเป็นผลิตภัณฑ์ระดับกลางที่เป็นที่รู้จักซึ่งทำหน้าที่เป็นพื้นฐานสำหรับการสังเคราะห์สารประกอบอื่น ๆ.
ศัพท์เฉพาะ
คีโตนตั้งชื่อตามลำดับความสำคัญหรือความสำคัญของกลุ่มคาร์บอนิลในโมเลกุลทั้งหมดดังนั้นเมื่อคุณมีโมเลกุลที่ควบคุมโดยกลุ่มคาร์บอนิลกลุ่มคีโตนจะถูกตั้งชื่อโดยเพิ่มคำต่อท้าย "-one" ให้กับชื่อของไฮโดรคาร์บอน.
สายโซ่ที่ยาวที่สุดที่มีกลุ่มคาร์บอนิลถูกใช้เป็นสายโซ่หลักแล้วจึงตั้งชื่อโมเลกุล หากกลุ่มคาร์บอนิลไม่ได้มีความสำคัญมากกว่ากลุ่มการทำงานอื่น ๆ ของโมเลกุลก็จะถูกระบุด้วย "-oxo".
สำหรับคีโตนที่ซับซ้อนมากขึ้นตำแหน่งของกลุ่มการทำงานสามารถระบุได้ด้วยจำนวนและในกรณีของ diketones (คีโตนที่มีสอง substituents เหมือนกัน R และ R ') โมเลกุลที่มีคำต่อท้าย "-dione" มีชื่อว่า.
ในที่สุดคำว่า "คีโตน" ก็สามารถใช้งานได้หลังจากระบุโซ่ของอนุมูลที่ติดอยู่กับกลุ่มการทำงานของคาร์บอนิล.
ความแตกต่างระหว่างอัลดีไฮด์และคีโตน
ความแตกต่างที่ยิ่งใหญ่ที่สุดระหว่างอัลดีไฮด์และคีโตนคือการมีอะตอมไฮโดรเจนที่ติดอยู่กับกลุ่มคาร์บอนิลในอัลดีไฮด์.
อะตอมนี้มีผลสำคัญเมื่อเกี่ยวข้องกับโมเลกุลในปฏิกิริยาออกซิเดชัน: อัลดีไฮด์จะเกิดกรดคาร์บอกซิลิกหรือเกลือของกรดคาร์บอกซิลิกขึ้นอยู่กับว่าปฏิกิริยาออกซิเดชันเกิดขึ้นภายใต้สภาวะที่เป็นกรดหรือพื้นฐาน.
ในทางตรงกันข้ามคีโตนไม่มีไฮโดรเจนนี้ดังนั้นขั้นตอนที่จำเป็นขั้นต่ำสำหรับการเกิดออกซิเดชันจึงไม่เกิดขึ้น.
มีวิธีในการออกซิไดซ์คีโตน (ด้วยตัวออกซิไดซ์ที่มีประสิทธิภาพมากกว่าที่ใช้โดยทั่วไป) แต่สิ่งเหล่านี้ทำลายโมเลกุลของคีโตนโดยแยกมันออกเป็นสองส่วนหรือมากกว่า.
อุตสาหกรรมและชีวิตประจำวันใช้
ในอุตสาหกรรมคีโตนมักพบเห็นได้ในน้ำหอมและสีทาหน้าที่คงตัวและสารกันบูดที่ป้องกันส่วนประกอบอื่น ๆ ของส่วนผสมไม่ให้เสื่อมสภาพ พวกเขายังมีสเปกตรัมกว้างเป็นตัวทำละลายในอุตสาหกรรมเหล่านั้นที่ผลิตวัตถุระเบิดสีและสิ่งทอนอกเหนือจากยา.
อะซิโตน (คีโตนขนาดเล็กที่สุดและง่ายที่สุด) เป็นตัวทำละลายที่ได้รับการยอมรับทั่วโลกและใช้เป็นน้ำยาล้างสีและทินเนอร์.
ในธรรมชาติคีโตนสามารถปรากฏเป็นน้ำตาลได้เรียกว่าคีโตส คีโตสคือโมโนแซคคาไรด์ที่มีคีโตนหนึ่งตัวต่อโมเลกุล คีโตนที่รู้จักกันดีที่สุดคือฟรุกโตสน้ำตาลที่พบในผลไม้และน้ำผึ้ง.
การสังเคราะห์กรดไขมันที่เกิดขึ้นภายในโปรโตปลาสซึมของเซลล์สัตว์ก็เกิดขึ้นผ่านการกระทำของคีโตน ในที่สุดและดังกล่าวข้างต้นอาจมีคีโตนสูงในเลือดหลังจากอดอาหารหรือในกรณีที่เป็นโรคเบาหวาน.
ตัวอย่างของคีโตน
Butanone (C4H)8O)
หรือที่เรียกว่า MEK (หรือ MEC) ของเหลวนี้ผลิตในอุตสาหกรรมขนาดใหญ่และใช้เป็นตัวทำละลาย.
Cyclohexanone (C6H10O)
คีโตนนี้ผลิตขึ้นในปริมาณมากใช้เป็นสารตั้งต้นสำหรับวัสดุไนลอนสังเคราะห์.
เทสโทสเตอโรน (C19H22O2)
มันเป็นฮอร์โมนหลักของเพศชายและสเตียรอยด์ anabolic ที่พบในกระดูกสันหลังส่วนใหญ่.
โปรเจสเตอโรน (C21H30O2)
สเตียรอยด์ภายนอกและฮอร์โมนเพศสัมพันธ์ที่เกี่ยวข้องกับรอบประจำเดือนการตั้งครรภ์และการเกิดเอ็มบริโอในมนุษย์และสปีชีส์อื่น ๆ.
การอ้างอิง
- วิกิพีเดีย ( N.d. ) คีโตน สืบค้นจาก en.wikipedia.org
- Britannica, E. (s.f. ) คีโตน สืบค้นจาก britannica.com
- มหาวิทยาลัย, M. S. (s.f. ) อัลดีไฮด์และคีโตน สืบค้นจากวิชาเคมี. su.edu
- ChemGuide ( N.d. ) แนะนำอัลดีไฮด์และคีโตน สืบค้นจาก chemguide.co.uk
- Calgary, U. O. (s.f. ) คีโตน สืบค้นจาก chem.ucalgary.ca


