คีโตนเจเนซิสประเภทของคีโตน, การสังเคราะห์และการสลายตัว
cetogénesis เป็นกระบวนการที่ acetoacetate, β-hydroxybutyrate และ acetone ได้มาซึ่งรวมกันเรียกว่าร่างคีโตน กลไกที่ซับซ้อนและมีการควบคุมอย่างประณีตนี้ดำเนินการในไมโตคอนเดรียจาก catabolism ของกรดไขมัน.
การได้รับของคีโตนร่างกายเกิดขึ้นเมื่อสิ่งมีชีวิตอยู่ภายใต้ระยะเวลาการอดอาหารอย่างละเอียดถี่ถ้วน แม้ว่าสารเหล่านี้จะถูกสังเคราะห์ในเซลล์ตับส่วนใหญ่พวกเขาพบว่าเป็นแหล่งพลังงานที่สำคัญในเนื้อเยื่อต่างๆเช่นกล้ามเนื้อโครงร่างและเนื้อเยื่อหัวใจและเนื้อเยื่อสมอง.
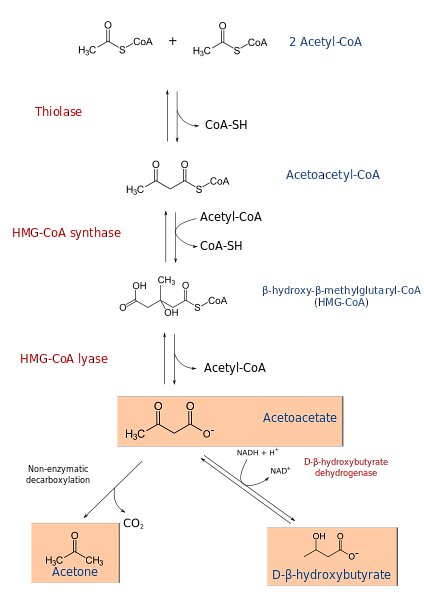
hydro-hydroxybutyrate และ acetoacetate เป็นสารที่ใช้เป็นสารตั้งต้นในกล้ามเนื้อหัวใจและไตนอก ในสมองร่างกายคีโตนกลายเป็นแหล่งพลังงานที่สำคัญเมื่อร่างกายมีปริมาณกลูโคสที่หมดไป.
ดัชนี
- 1 ลักษณะทั่วไป
- 2 ประเภทและคุณสมบัติของคีโตน
- 3 การสังเคราะห์คีโตน
- 3.1 เงื่อนไขสำหรับการสร้างคีโตน
- 3.2 กลไก
- 3.3 β-oxidation และ ketogenesis สัมพันธ์กัน
- 3.4 การควบคุมการเกิดออกซิเดชันและผลกระทบต่อการสร้างคีโตจีเนส
- 4 การสลายตัว
- 5 ความเกี่ยวข้องทางการแพทย์ของร่างกายคีโตน
- 5.1 โรคเบาหวานและการสะสมของคีโตน
- 6 อ้างอิง
ลักษณะทั่วไป
Ketogenesis ถือเป็นหน้าที่ทางสรีรวิทยาที่สำคัญมากหรือเส้นทางการเผาผลาญ โดยทั่วไปกลไกนี้จะดำเนินการในตับแม้ว่าจะได้รับการแสดงให้เห็นว่ามันสามารถดำเนินการในเนื้อเยื่ออื่น ๆ ที่มีความสามารถในการเผาผลาญกรดไขมัน.
การก่อตัวของคีโตนเป็นอนุพันธ์ทางเมตาบอลิซึมหลักของ acetyl-CoA เมตาโบไลต์นี้ได้มาจากเส้นทางเมตาบอลิซึมที่รู้จักกันในชื่อβ-oxidation ซึ่งเป็นการสลายตัวของกรดไขมัน.
ความพร้อมใช้งานของกลูโคสในเนื้อเยื่อที่เกิด oxid-oxidation เป็นตัวกำหนดชะตากรรมการเผาผลาญของ acetyl-CoA โดยเฉพาะอย่างยิ่งในสถานการณ์กรดไขมันที่ถูกออกซิไดซ์จะถูกนำไปเกือบทั้งหมดในการสังเคราะห์คีโตน.
ประเภทและคุณสมบัติของคีโตน
ร่างกายคีโตนหลักคือ acetoacetate หรือกรด acetoacetic ซึ่งส่วนใหญ่จะถูกสังเคราะห์ในเซลล์ตับ โมเลกุลอื่น ๆ ที่ประกอบขึ้นเป็นคีโตนนั้นมาจากอะเซโตเตสเตต.
การลดลงของ acetoacetic acid ก่อให้เกิด D-hydro-hydroxybutyrate ซึ่งเป็นคีโตนตัวที่สอง อะซิโตนเป็นสารประกอบยากที่จะย่อยสลายและผลิตโดยปฏิกิริยาที่เกิดขึ้นเองของ decarboxylation ของ acetoacetate (ดังนั้นจึงไม่จำเป็นต้องมีการแทรกแซงของเอนไซม์ใด ๆ ) เมื่อมันอยู่ในความเข้มข้นสูงในเลือด.
การกำหนดร่างของคีโตนได้ถูกจัดโดยการประชุมเนื่องจากการพูดอย่างเคร่งครัดβ-hydroxybutyrate ไม่ได้มีฟังก์ชั่นคีโตน โมเลกุลทั้งสามนี้ละลายได้ในน้ำซึ่งช่วยในการขนส่งในเลือด หน้าที่หลักคือการให้พลังงานแก่เนื้อเยื่อบางอย่างเช่นกล้ามเนื้อโครงร่างและกล้ามเนื้อหัวใจ.
เอนไซม์ที่เกี่ยวข้องกับการก่อตัวของคีโตนส่วนใหญ่อยู่ในตับและเซลล์ไตซึ่งอธิบายได้ว่าทำไมทั้งสองสถานที่นี้จึงเป็นผู้ผลิตหลักของสารเหล่านี้ การสังเคราะห์เกิดขึ้นเฉพาะในเมทริกซ์ยลของเซลล์เท่านั้น.
เมื่อโมเลกุลเหล่านี้ถูกสังเคราะห์พวกมันจะเข้าสู่กระแสเลือดและไปยังเนื้อเยื่อที่ต้องการพวกมันซึ่งจะไปสลาย acetyl-CoA.
การสังเคราะห์คีโตน
เงื่อนไขสำหรับการสร้างคีโตน
ชะตากรรมเผาผลาญของ acetyl-CoA จาก oxid-oxidation ขึ้นอยู่กับความต้องการการเผาผลาญของสิ่งมีชีวิต นี่คือออกซิไดซ์ไปยัง CO2 และเอช2หรือผ่านวงจรกรดซิตริกหรือการสังเคราะห์กรดไขมันหากเมแทบอลิซึมของไขมันและคาร์โบไฮเดรตมีความเสถียรในร่างกาย.
เมื่อร่างกายต้องการการสะสมของคาร์โบไฮเดรตจะใช้ oxaloacetate เพื่อผลิตกลูโคส (gluconeogenesis) แทนการเริ่มวงจรกรดซิตริก สิ่งนี้เกิดขึ้นตามที่ได้กล่าวไว้เมื่อร่างกายไม่สามารถรับกลูโคสในบางกรณีเช่นการอดอาหารเป็นเวลานานหรือการปรากฏตัวของโรคเบาหวาน.
ด้วยเหตุนี้ acetyl-CoA ซึ่งเป็นผลมาจากปฏิกิริยาออกซิเดชันของกรดไขมันจึงถูกนำมาใช้ในการผลิตคีโตน.
กลไก
กระบวนการสร้างคีตาจีเนซิสเริ่มต้นจากผลิตภัณฑ์ของβ-oxidation: acetacetyl-CoA หรือ acetyl-CoA เมื่อสารตั้งต้นคือ acetyl-CoA ขั้นตอนแรกเกี่ยวข้องกับการควบแน่นของโมเลกุลสองโมเลกุลปฏิกิริยาที่เร่งปฏิกิริยาโดย acetyl-CoA transferase เพื่อสร้าง acetacetyl-CoA.
Acetacetyl-CoA ย่อมาจาก acetyl-CoA ตัวที่สามโดยการกระทำของ HMG-CoA synthase เพื่อผลิต HMG-CoA (β-hydroxy-β-methylglutaryl-CoA) HMG-CoA ถูกลดระดับลงเป็น acetoacetate และ acetyl-CoA โดยการกระทำของ HMG-CoA lyase ด้วยวิธีนี้ร่างกายได้รับ ketonic แรก.
Acetoacetate จะลดลงเป็นβ-hydroxybutyrate โดยการแทรกแซงของβ-hydroxybutyrate dehydrogenase ปฏิกิริยานี้ขึ้นอยู่กับ NADH.
ร่างกายหลักของคีโตน acetoacetate คือกรด k-keto ซึ่งผ่านการกำจัดเอนไซม์ที่ไม่มีเอนไซม์ กระบวนการนี้ง่ายและผลิตอะซีโตนและ CO2.
ปฏิกิริยาชุดนี้จึงก่อให้เกิดร่างคีโตน สิ่งเหล่านี้สามารถละลายได้ในน้ำสามารถเคลื่อนย้ายได้อย่างง่ายดายผ่านทางกระแสเลือดโดยไม่จำเป็นต้องยึดติดกับโครงสร้างอัลบูมินเช่นกรณีของกรดไขมันที่ไม่ละลายในตัวกลางน้ำ.
Β-oxidation และ ketogenesis สัมพันธ์กัน
เมแทบอลิซึมของกรดไขมันสร้างสารตั้งต้นสำหรับคีโตจีเนสดังนั้นวิถีทั้งสองนี้จึงสัมพันธ์กันตามหน้าที่.
Acetoacetyl-CoA เป็นตัวยับยั้งการเผาผลาญกรดไขมันเนื่องจากจะหยุดการทำงานของ acyl-CoA dehydrogenase ซึ่งเป็นเอนไซม์ตัวแรกของβ-oxidation นอกจากนี้ยังออกแรงยับยั้ง acetyl-CoA transferase และ HMG-CoA synthase.
เอนไซม์ HMG-CoA synthase, รองโดย CPT-I (เอนไซม์ที่เกี่ยวข้องกับการผลิต acyl carnitine ในβ-oxidation) แสดงถึงบทบาทสำคัญในการก่อตัวของกรดไขมัน.
ระเบียบของβ-oxidation และผลกระทบต่อ ketogenesis
การให้อาหารสิ่งมีชีวิตจะควบคุมชุดสัญญาณฮอร์โมนที่ซับซ้อน คาร์โบไฮเดรตกรดอะมิโนและไขมันที่บริโภคในอาหารจะถูกสะสมในรูปแบบของ triacylglycerols ในเนื้อเยื่อไขมัน อินซูลินฮอร์โมนอะนาโบลิกมีส่วนเกี่ยวข้องในการสังเคราะห์ไขมันและการก่อตัวของ triacylglycerols.
ในระดับไมโตคอนเดรียนั้นการเกิดออกซิเดชั่นจะถูกควบคุมโดยการเข้าและการมีส่วนร่วมของสารตั้งต้นบางชนิดในไมโตคอนเดรีย เอนไซม์ CPT I สังเคราะห์ Acyl Carnitine จาก cytosolic Acyl CoA.
เมื่อสิ่งมีชีวิตถูกป้อนเข้ามา acetyl-CoA carboxylase จะถูกกระตุ้นและซิเตรตจะเพิ่มระดับของ CPT I ในขณะที่ phosphorylation จะลดลง (ปฏิกิริยาขึ้นกับวงจร AMP).
สิ่งนี้ทำให้เกิดการสะสมของ malonyl CoA ซึ่งกระตุ้นการสังเคราะห์กรดไขมันและยับยั้งการเกิดออกซิเดชันของพวกเขาป้องกันวงจรไร้ประโยชน์จากการถูกสร้างขึ้น.
ในกรณีของการอดอาหารกิจกรรมของ carboxylase ต่ำมากเนื่องจากระดับของเอนไซม์ CPT I ได้ลดลงและมันได้รับการฟอสฟอรีเลด, กระตุ้นและส่งเสริมการเกิดออกซิเดชันของไขมันในเลือดซึ่งในภายหลังจะช่วยให้การก่อตัวของ ของ acetyl-CoA.
การปลด
ร่างกายของคีโตนกระจายออกจากเซลล์ที่พวกเขาสังเคราะห์และเคลื่อนย้ายไปยังเนื้อเยื่อรอบนอกโดยกระแสเลือด ในเนื้อเยื่อเหล่านี้พวกเขาสามารถออกซิไดซ์ผ่านวัฏจักรกรด tricarboxylic.
ในเนื้อเยื่อรอบข้างβ-hydroxybutyrate จะถูกออกซิไดซ์เป็น acetoacetate ต่อมาอะเซโตเซเตทในปัจจุบันจะถูกกระตุ้นโดยเอนไซม์ 3-ketoacyl-CoA transferase.
Succinyl-CoA ทำหน้าที่เป็นผู้บริจาค CoA การเปิดใช้งานของ acetoacetate เกิดขึ้นเพื่อป้องกันไม่ให้ succinyl-CoA กลายเป็น succinate ในวงจรกรดซิตริกกับการสังเคราะห์คู่ของ GTP โดยการกระทำของซัคซิน - CoA synthase.
acetoacetyl-CoA ที่ได้รับผ่านรอยแยก thiolitic ที่ผลิตโมเลกุล acetyl-CoA สองโมเลกุลที่รวมอยู่ในวัฏจักรของกรด tricarboxylic หรือที่รู้จักกันดีในชื่อวงจร Krebs.
เซลล์ตับขาด 3-ketoacyl-CoA transferase ป้องกันไม่ให้สารนี้ถูกเปิดใช้งานในเซลล์เหล่านี้ ด้วยวิธีนี้จึงรับประกันได้ว่าร่างกายของคีโตนจะไม่ถูกออกซิไดซ์ในเซลล์ที่พวกมันถูกสร้างขึ้น แต่พวกมันสามารถถ่ายโอนไปยังเนื้อเยื่อที่จำเป็นต้องมีกิจกรรมของพวกเขา.
ความเกี่ยวข้องทางการแพทย์ของร่างกายคีโตน
ในร่างกายมนุษย์ความเข้มข้นสูงของร่างกายคีโตนในเลือดอาจทำให้เกิดภาวะพิเศษที่เรียกว่าภาวะเลือดเป็นกรดและโรคโลหิตจาง.
การผลิตสารเหล่านี้สอดคล้องกับ catabolism ของกรดไขมันและคาร์โบไฮเดรต หนึ่งในสาเหตุที่พบบ่อยที่สุดของเงื่อนไขการเกิดคีโตจีเนสพยาธิวิทยาคือความเข้มข้นสูงของชิ้นส่วนอะซิติกไดโคคาเนตที่ไม่ได้สลายตัวโดยวิถีออกซิเดชันของกรดไตรคาร์บอกซิลิก.
เป็นผลให้มีการเพิ่มขึ้นของระดับของร่างกายคีโตนในเลือดสูงกว่า 2 ถึง 4 มก. / 100 นิวตันและการปรากฏตัวของพวกเขาในปัสสาวะ ซึ่งส่งผลให้เกิดการรบกวนของการเผาผลาญตัวกลางของสารดังกล่าว.
ข้อบกพร่องบางอย่างในปัจจัยต่อมใต้สมอง neuroglandular ที่ควบคุมการสลายตัวและการสังเคราะห์ของคีโตนร่างกายพร้อมกับความผิดปกติในการเผาผลาญของไฮโดรคาร์บอนเป็นสาเหตุของภาวะ hypercetonemia.
โรคเบาหวานและการสะสมของคีโตนร่างกาย
โรคเบาหวาน (ชนิดที่ 1) เป็นโรคต่อมไร้ท่อที่ทำให้เพิ่มการผลิตของร่างกายคีโตน การผลิตอินซูลินไม่เพียงพอจะเป็นการปิดการขนส่งกลูโคสไปยังกล้ามเนื้อตับและเนื้อเยื่อไขมันจึงสะสมในเลือด.
เซลล์ที่ไม่มีกลูโคสจะเริ่มกระบวนการสร้าง gluconeogenesis และสลายไขมันและโปรตีนเพื่อเผาผลาญ เป็นผลให้ความเข้มข้นของ oxaloacetate ลดลงและการเกิดออกซิเดชันของไขมันเพิ่มขึ้น.
จากนั้นมีการสะสมของ acetyl-CoA ซึ่งในกรณีที่ไม่มี oxaloacetate ไม่สามารถไปตามเส้นทางกรดซิตริกทำให้เกิดการผลิตสูงของร่างกายคีโตนลักษณะของโรคนี้.
การสะสมของอะซิโตนจะถูกตรวจพบโดยการมีอยู่ในปัสสาวะและลมหายใจของผู้ที่มีอาการนี้และในความเป็นจริงเป็นหนึ่งในอาการที่บ่งบอกถึงการรวมตัวของโรคนี้.
การอ้างอิง
- Blázquez Ortiz, C. (2004). คีโตจีเนซิสในแอสโทรเจน: การจำแนกลักษณะ, การควบคุมและบทบาทไซโตโรทีครอป (วิทยานิพนธ์ปริญญาเอก, Universidad Complutense de Madrid, บริการเผยแพร่).
- Devlin, T. M. (1992). ตำราวิชาชีวเคมี: มีความสัมพันธ์ทางคลินิก.
- Garrett, R. H. , & Grisham, C. M. (2008). ชีวเคมี. Thomson Brooks / Cole.
- McGarry, J. D. , Mannaerts, G. P. , & Foster, D. W. (1977) บทบาทที่เป็นไปได้สำหรับ malonyl-CoA ในการควบคุมการเกิดออกซิเดชันของกรดไขมันในตับและคีโตจีเอส. วารสารการสืบสวนทางคลินิก, 60(1), 265-270.
- Melo, V. , Ruiz, V. M. , & Cuamatzi, O. (2007). ชีวเคมีของกระบวนการเผาผลาญ. Reverte.
- Nelson, D.L. , Lehninger, A.L. , & Cox, M.M. (2008). หลักการทางชีวเคมีของ Lehninger. Macmillan.
- Pertierra, A. G. , Gutiérrez, C. V. , และอื่น ๆ , C. M. (2000). พื้นฐานของชีวเคมีเผาผลาญ. Tébarบรรณาธิการ.
- Voet, D. , & Voet, J. G. (2006). ชีวเคมี. Ed. Panamericana การแพทย์.


