ลักษณะของ Trypanosoma brucei สัณฐานวิทยาวัฏจักรชีวภาพอาการ
Trypanosoma brucei มันเป็นโปรโตซัวปรสิตนอกเซลล์ เป็นของคลาส Kinetoplastidae ตระกูล Trypanosomatidae สกุล Trypanosoma. มีสองสายพันธุ์ย่อยที่ทำให้เกิดเชื้อสองสายพันธุ์ที่แตกต่างกันของ trypanosomiasis มนุษย์แอฟริกันหรือที่เรียกว่า "โรคไข้หลับ".
Trypanosoma brucei subsp. gambiense, ทำให้เกิดรูปแบบเรื้อรังและ 98% ของกรณีที่ตั้งอยู่ในตะวันตกและภาคกลางของทะเลทรายซาฮารา. Trypanosoma brucei subsp. rhodesiense เป็นสาเหตุของรูปแบบเฉียบพลันที่มีอยู่ในใจกลางและทางตะวันออกของแอฟริกาซาฮาราย่อย.
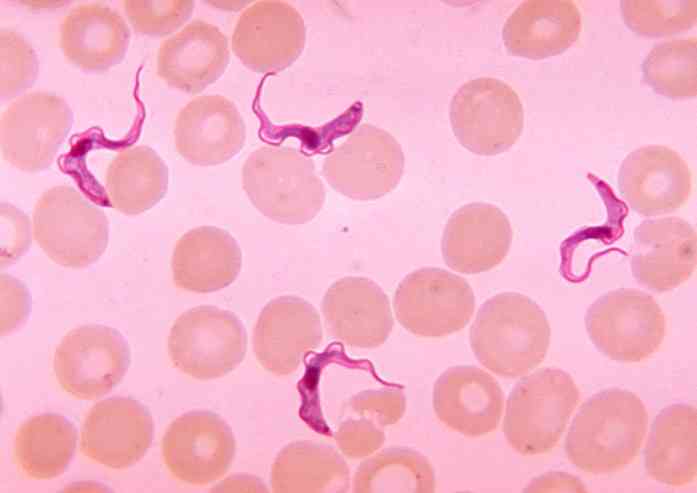
ทั้งสองสายพันธุ์ของโรคนี้ได้รับการรายงานในประเทศเหล่านั้นของอนุภูมิภาคทะเลทรายซาฮาราซึ่งพบว่าแมลงวัน tsetse บิน, Glossina spp, เวกเตอร์หรือตัวแทนส่งสัญญาณของ ต. brucei.
สายพันธุ์ที่สาม, Trypanosoma brucei subsp. brucei, ทำให้เกิดโรคที่คล้ายกันในสัตว์เลี้ยงและสัตว์ป่าที่เรียกว่านากาน่า.
"โรคนอนไม่หลับ" คุกคามประชากรกว่า 60 ล้านคนใน 36 ประเทศในอนุภูมิภาคทะเลทรายซาฮารา มีประมาณ 300,000 ถึง 500,000 รายต่อปีซึ่งประมาณ 70,000 ถึง 100,000 รายเสียชีวิต การรบกวนโดยแมลงวัน tsetse ครอบคลุมอาณาเขต 10 ล้านตารางกิโลเมตรซึ่งเป็นหนึ่งในสามของทวีปแอฟริกา.
องค์การอนามัยโลกตระหนักถึงการลดจำนวนผู้ป่วย trypanosomiasis ในแอฟริกาในช่วงไม่กี่ปีที่ผ่านมา นี่คือสาเหตุของการคงอยู่ของความคิดริเริ่มระดับชาติและนานาชาติในการควบคุมโรคนี้.
ดัชนี
- 1 ลักษณะทั่วไป
- 1.1 การค้นพบ
- 1.2 พันธุศาสตร์
- 1.3 การ "นอนไม่หลับ" และภาวะโลกร้อน
- 2 Phylogeny และอนุกรมวิธาน
- 3 สัณฐานวิทยา
- 3.1 แบบฟอร์ม Tryomastigote
- 3.2 แบบฟอร์ม Epimastigote
- 3.3 kinetosome
- 4 วงจรชีวภาพ
- 4.1 ในโฮสต์ (คนหรือสัตว์เลี้ยงลูกด้วยนมอื่น ๆ )
- 4.2 ในแมลงวัน tsetse (เวกเตอร์)
- 5 อาการของการติดเชื้อ
- 5.1 ระยะแรก
- 5.2 ระยะที่สอง
- 5.3 การวินิจฉัย
- 6 การรักษา
- 7 อ้างอิง
ลักษณะทั่วไป
มันถูกเรียกว่า "โรคไข้หลับ" เพราะมันจะทำให้เกิดการผกผันของวงจรการนอนหลับของผู้ป่วยตามธรรมชาติ บุคคลนั้นนอนระหว่างวันและตื่นนอนตอนกลางคืน นี่คือผลิตภัณฑ์ของชุดของการรบกวนจิตใจและระบบประสาทที่ทำให้เกิดโรคในระยะขั้นสูงของมัน.
การค้นพบ
trypanosomiasis สัตว์หรือนากาน่าเป็นโรคที่สำคัญในวัวในแอฟริกา เขาระบุตัวเอง Trypanosoma brucei ในฐานะตัวแทนสาเหตุในปี 1899 มันเป็น David Bruce ในขณะที่ตรวจสอบการระบาดครั้งใหญ่ของ Nagana ใน Zululand.
ต่อมา Aldo Castellani ระบุชนิดของ trypanosome ในเลือดและน้ำไขสันหลังของผู้ป่วยมนุษย์ที่มี "โรคไข้หลับ".
ระหว่างปีพ. ศ. 2445 และ 2453 ทั้งสองรูปแบบของโรคในมนุษย์และชนิดย่อยสาเหตุของพวกเขาถูกระบุ ทั้งสัตว์และมนุษย์สามารถทำหน้าที่เป็นแหล่งกักกันของปรสิตที่สามารถทำให้เกิดโรคในมนุษย์ได้.
พันธุศาสตร์
จีโนมของนิวเคลียสของ Trypanosoma brucei มันถูกสร้างขึ้นจากโครโมโซมซ้ำ 11 และ microchromosomes ร้อย ทั้งหมดมียีน 9,068 ตัว จีโนมของไมโทคอนเดรีย (kinetoplast) ประกอบด้วย DNA เวียนจำนวนมาก.
"การนอนไม่หลับ" และภาวะโลกร้อน
trypanosomiasis คนแอฟริกันเป็นหนึ่งใน 12 โรคติดเชื้อของมนุษย์ที่สามารถทำให้รุนแรงขึ้นจากภาวะโลกร้อน.
นี่คือความจริงที่ว่าเมื่ออุณหภูมิโดยรอบเพิ่มขึ้นพื้นที่ที่ไวต่อการถูกแมลงวันจะถูกขยาย Glossina sp. เมื่อตั้งอาณานิคมดินแดนใหม่บินมันจะใช้เวลากับปรสิต.
สายเลือดและอนุกรมวิธาน
Trypanosoma brucei pเป็นของราชอาณาจักร Protista, กลุ่ม Excavata, ไฟลัม Euglenozoa, ระดับ Kinetoplastidae, สั่ง Trypanosomatida, ครอบครัว Trypanosomatidae, สกุล Trypanosoma, ประเภทย่อย Tripanozoon.
สายพันธุ์นี้มีสามสายพันธุ์ย่อยที่ทำให้เกิดความแตกต่างของ "โรคไข้หลับ" ในมนุษย์ (ต. ข. subsp. gambiense และ ต. ข. subsp Rhodesiense) และในสัตว์เลี้ยงและสัตว์ป่า (ต. ข. subsp. brucei).
ลักษณะทางสัณฐานวิทยา
แบบฟอร์ม Tripomastigote
Trypanosoma brucei เป็นสิ่งมีชีวิตเซลล์เดียวที่มีความยาว 20 μmและกว้าง 1-3 μmซึ่งมีรูปร่างโครงสร้างและองค์ประกอบของเมมเบรนแตกต่างกันไปตามวงจรชีวิต.
มันมีสองรูปแบบพื้นฐาน รูปแบบ Tripomastigote ของฐานร่างกายด้านหลังไปยังนิวเคลียสและ flagellum ยาว แบบฟอร์มนี้จะถือว่าเป็นเชื้อชนิดย่อยในระหว่างวงจรชีวิต ของเหล่านี้สั้นหรือตอไม้ชนิดย่อย (slumpy ในภาษาอังกฤษ) มันหนาขึ้นและแฟลเจลลัมสั้น.
แบบฟอร์ม Epimastigote
รูปแบบพื้นฐานที่สองคือ epimastigote ของร่างกายฐานหน้านิวเคลียสและ flagellum ค่อนข้างสั้นกว่าก่อนหน้าหนึ่ง.
เซลล์ถูกปกคลุมด้วยชั้นของ glycoprotein ผิวตัวแปร ชั้นนี้จะเปลี่ยน glycoproteins ของพื้นผิวของมันและทำให้เกิดการโจมตีของแอนติบอดีที่สร้างโดยโฮสต์.
ระบบภูมิคุ้มกันสร้างแอนติบอดีใหม่เพื่อโจมตีการกำหนดค่าใหม่ของเลเยอร์และการเปลี่ยนแปลงเลเยอร์อีกครั้ง มันคือสิ่งที่เรียกว่าการเปลี่ยนแปลงของแอนติเจน.
kinetosoma
คุณสมบัติที่สำคัญคือการปรากฏของ kinetosoma โครงสร้างนี้ประกอบด้วย DNA ไมโตคอนเดรียควบแน่นที่อยู่ภายในไมโตคอนเดรียตัวเดียวเท่านั้น ไมโตคอนเดรียขนาดใหญ่นี้ตั้งอยู่ที่ฐานของโรคระบาด.
วัฏจักรทางชีวภาพ
วงจรชีวิตของ Trypanosoma brucei สลับไปมาระหว่าง tsetse บินเป็นเวกเตอร์และมนุษย์ในฐานะเจ้าภาพ เพื่อพัฒนาในโฮสต์ที่แตกต่างกันโปรโตซูนผ่านการเปลี่ยนแปลงทางเมตาบอลิซึมและสัณฐานวิทยาที่สำคัญจากที่หนึ่งไปยังอีก.
ในการบิน Trypanosoma brucei พำนักอยู่ในทางเดินอาหารในขณะที่ในมนุษย์จะพบได้ในเลือด.
ในโฮสต์ (คนหรือสัตว์เลี้ยงลูกด้วยนมอื่น ๆ )
Trypanosoma brucei มันมาในสามรูปแบบพื้นฐานตลอดวงจร เมื่อแมลงวันกัดสัตว์หรือสัตว์เลี้ยงลูกด้วยนมอื่น ๆ เพื่อสกัดเลือดมันจะฉีดจากต่อมน้ำลายเข้าสู่กระแสเลือดซึ่งเป็นรูปแบบที่ไม่มีการแพร่กระจายของโปรโตซัวที่เรียกว่าเมตาไซคลิก.
เมื่ออยู่ในกระแสเลือดก็จะถูกเปลี่ยนเป็นรูปแบบการเจริญที่เรียกว่าเลือดเรียว (เรียว ในภาษาอังกฤษ).
รูปแบบของเลือดเรียว Trypanosoma brucei มันได้รับพลังงานจาก glycolysis ของกลูโคสที่มีอยู่ในเลือด กระบวนการเมแทบอลิซึมนี้ทำในออร์แกเนลล์ที่เรียกว่า Trypanosomes เหล่านี้คูณในของเหลวต่าง ๆ ของร่างกาย: เลือดน้ำเหลืองและน้ำไขสันหลัง.
เมื่อจำนวนของปรสิตในเลือดเพิ่มขึ้นพวกเขาก็เริ่มเปลี่ยนไปเป็นรูปแบบที่ไม่เจริญ คราวนี้มันเป็นตัวแปรที่หนากว่าด้วยแฟลเจลลัมสั้นเรียกว่าเลือดอวบอ้วนเตี้ย).
ทริโนโซโซมเลือดแบบหัวใต้ดินถูกปรับให้เข้ากับสภาพของระบบย่อยอาหารของแมลงวัน พวกเขาเปิดใช้งาน mitochondria และเอนไซม์ที่จำเป็นสำหรับวงจรของกรดซิตริกและสายโซ่ระบบทางเดินหายใจ แหล่งพลังงานไม่ใช่กลูโคสอีกต่อไปแล้ว.
ในแมลงวัน tse-tsé (เวกเตอร์)
เวกเตอร์หรือตัวแทนส่งสัญญาณของ Trypanosoma brucei มันคือการบิน Tse-Tse, Glossina spp. สกุลนี้จัดกลุ่มแมลงวัน hematophagous 25 ถึง 30 สายพันธุ์ พวกมันง่ายที่จะแยกแยะความแตกต่างจากแมลงวันทั่วไปโดยงวงยาวและปีกที่พับเก็บได้อย่างเต็มที่.
เมื่อแมลงวัน tsetse กัดสัตว์เลี้ยงลูกด้วยนมที่ติดเชื้อแล้วดึงเลือดออกเลือดที่มีขนแข็งเหล่านี้จะแทรกซึมเวกเตอร์.
เมื่ออยู่ในระบบย่อยอาหารของแมลงวันเลือดแข็งตัวกลายเป็นความแตกต่างอย่างรวดเร็วใน procyclic proliferative trypanosomes.
พวกเขาคูณด้วยฟิชชันแบบไบนารี พวกเขาออกจากทางเดินอาหารของแมลงวันและไปที่ต่อมน้ำลาย พวกมันจะถูกเปลี่ยนเป็น Epimastigote ที่ถูกยึดติดกับผนังโดยต้นเหตุของความหายนะ.
ในต่อมน้ำลายพวกเขาทวีคูณและแปลงร่างเป็นเมตาไซคลิกอะมิโนไซโคลพร้อมที่จะฉีดวัคซีนอีกครั้งในระบบเลือดของสัตว์เลี้ยงลูกด้วยนม.
อาการของการติดเชื้อ
ระยะฟักตัวของโรคนี้คือ 2 ถึง 3 วันหลังจากแมลงวันกัด อาการทางระบบประสาทอาจเกิดขึ้นหลังจากไม่กี่เดือนในกรณีของ T. b subsp. gambiense. หากเป็นเรื่องของ ต. ข. subsp. rhodesiense, มันอาจใช้เวลาเป็นปีที่จะประจักษ์.
ระยะแรก
"โรคภัยไข้เจ็บนอนหลับ" มีสองขั้นตอน ครั้งแรกที่เรียกว่าช่วงแรกหรือระยะเม็ดเลือดแดงก็เป็นลักษณะการปรากฏตัวของ Trypanosoma brucei เฉพาะในเลือดและน้ำเหลือง.
ในกรณีนี้มีอาการไข้ปวดศีรษะปวดเมื่อยกล้ามเนื้ออาเจียนต่อมน้ำเหลืองบวมน้ำหนักลดความอ่อนแอและหงุดหงิด.
ในระยะนี้โรคนี้อาจสับสนกับมาลาเรีย.
ระยะที่สอง
ระยะปลายหรือระบบประสาทที่เรียกว่า (encephalitic state) ถูกกระตุ้นโดยการมาถึงของปรสิตในระบบประสาทส่วนกลางซึ่งถูกตรวจพบในน้ำไขสันหลัง - ไขสันหลัง นี่คืออาการที่แสดงการเปลี่ยนแปลงในพฤติกรรมความสับสนไม่ประสานกันการเปลี่ยนแปลงของวงจรการนอนหลับและในที่สุดอาการโคม่า.
การพัฒนาของโรคยังคงมีรอบถึงสามปีในกรณีของสายพันธุ์ย่อย gambiense, ลงท้ายด้วยความตาย เมื่อมีสายพันธุ์ย่อยอยู่ rhodesiense, ความตายมาจากสัปดาห์ถึงเดือน.
ในกรณีที่ไม่ได้รับการรักษา 100% ตาย 2-8% ของผู้ป่วยที่ได้รับการรักษาก็ตายเช่นกัน.
การวินิจฉัยโรค
ขั้นตอนการวินิจฉัยคือเมื่อรูปแบบการติดเชื้อคือ trypanosome เลือดพบในเลือด.
โดยการตรวจตัวอย่างเลือดด้วยกล้องจุลทรรศน์จะตรวจพบรูปแบบเฉพาะของปรสิต ในระยะ encephalitic จำเป็นต้องเจาะเอวเพื่อวิเคราะห์น้ำไขสันหลัง.
มีเทคนิคโมเลกุลหลายอย่างในการวินิจฉัยการปรากฏตัวของ Trypanosoma brucei.
การรักษา
ความจุที่มี Trypanosoma brucei จากการเปลี่ยนแปลงโครงสร้างของ glycoproteins (การเปลี่ยนแปลงของแอนติเจน) อย่างต่อเนื่องทำให้การพัฒนาวัคซีนต่อต้าน "โรคไข้หลับ" ได้ยากมาก.
ไม่มีเคมีบำบัดป้องกันโรคและมีโอกาสเพียงเล็กน้อยหรือไม่มีวัคซีน ยาหลักสี่ชนิดที่ใช้สำหรับ trypanosomiasis ในแอฟริกาของมนุษย์มีพิษ.
Melarsoprol เป็นยาตัวเดียวที่มีประสิทธิภาพสำหรับทั้งสองสายพันธุ์ของโรคระบบประสาทส่วนกลาง อย่างไรก็ตามมันเป็นพิษอย่างมากที่จะสังหารผู้ป่วยที่ได้รับมัน 5%.
Eflornithine เพียงอย่างเดียวหรือใช้ร่วมกับ nifurtimox มีการใช้มากขึ้นเป็นบรรทัดแรกของการบำบัดสำหรับโรคที่เกิดจาก Trypanosoma brucei subsp. gambiense.
การอ้างอิง
- Fenn K และ KR Matthews (2007) ชีววิทยาของเซลล์ของความแตกต่างของ Trypanosoma brucei ความคิดเห็นปัจจุบันทางจุลชีววิทยา 10: 539-546.
- Fernández-Moya SM (2013) ลักษณะการทำงานของ RNA ที่มีผลผูกพันโปรตีน RBP33 และ DRBD3 เป็นหน่วยงานกำกับดูแลการแสดงออกของยีน Trypanosoma brucei. วิทยานิพนธ์ปริญญาเอก สถาบันปรสิตวิทยาและชีวการแพทย์ "López-Neyra" มหาวิทยาลัยบรรณาธิการของกรานาดา, สเปน 189 หน้า.
- García-Salcedo JA, D Pérez-Morga, P Gijón, V Dilbeck, E Pays และ DP Nolan (2004) บทบาทที่แตกต่างของ Actin ในช่วงวงจรชีวิตของ Trypanosoma brucei วารสาร EMBO 23: 780-789.
- Kennedy PGE (2008) ปัญหาต่อเนื่องของ trypanosomiasis ในแอฟริกาของมนุษย์ พงศาวดารของประสาทวิทยา, 64 (2), 116-126.
- Matthews KR (2005) ชีววิทยาเซลล์พัฒนาการของ Trypanosoma brucei. J. Cell Sci 118: 283-290.
- Welburn SC, EM Fèvre, PG Coleman, M Odiit และ I Maudlin (2001) โรคนอนหลับ: เรื่องราวของโรคสองโรค แนวโน้มในปรสิตวิทยา 17 (1): 19-24.


