Ziehl-Neelsen Stain Foundation น้ำยาและเทคนิค
Ziehl-Neelsen คราบ ในเทคนิคการระบายสีเพื่อระบุจุลินทรีย์ทนกรดแอลกอฮอล์ (AAR) ชื่อของกระบวนการทางจุลชีววิทยานี้อ้างถึงผู้แต่ง: นักแบคทีเรียวิทยา Franz Ziehl และนักพยาธิวิทยา Friedrich Neelsen.
เทคนิคนี้เป็นประเภทของการย้อมสีที่แตกต่างซึ่งแสดงถึงการใช้สีย้อมต่าง ๆ เพื่อสร้างความแตกต่างระหว่างโครงสร้างที่คุณต้องการที่จะสังเกตเห็นความแตกต่างและการระบุในภายหลัง Ziehl-Neelsen stain ใช้เพื่อระบุจุลินทรีย์บางประเภท.
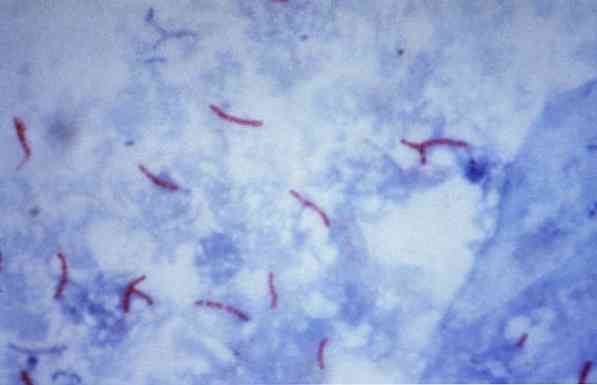
จุลินทรีย์เหล่านี้บางชนิดเป็นเชื้อมัยโคแบคทีเรีย (ตัวอย่างเช่น, วัณโรคมัยโคแบคทีเรีย), nocardias (ตัวอย่างเช่น, Nocardia sp.) และปรสิตที่มีเซลล์เดียว (ตัวอย่างเช่น, Cryptosporidium parvum) แบคทีเรียจำนวนมากสามารถจำแนกได้โดยใช้เทคนิคทั่วไปที่เรียกว่า Gram stain.
อย่างไรก็ตามกลุ่มแบคทีเรียบางกลุ่มต้องการวิธีการอื่นเพื่อระบุ เทคนิคเช่นการย้อมสี Ziehl-Neelsen จำเป็นต้องใช้สีย้อมผสมกับความร้อนเพื่อยึดติดกับผนังเซลล์ก่อน.
จากนั้นกระบวนการเปลี่ยนสีที่ช่วยให้ได้ผลลัพธ์สองประการ ได้แก่ ความต้านทานหรือความไวต่อการเปลี่ยนสีโดยกรดและแอลกอฮอล์.
ดัชนี
- 1 มูลนิธิ
- 1.1 การระบายสีรอง
- 2 รีเอเจนต์
- 2.1 ระบายสีเบื้องต้น
- 2.2 แก้ปัญหาการลดสี
- 2.3 สีรอง (สีต่อต้าน)
- 3 เทคนิค
- 3.1 ขั้นตอนการย้อมสีด้วยกรดอย่างรวดเร็ว
- 4 อ้างอิง
มูลนิธิ
พื้นฐานของเทคนิคการย้อมสีนี้ขึ้นอยู่กับคุณสมบัติของผนังเซลล์ของจุลินทรีย์เหล่านี้ ผนังเกิดจากกรดไขมันชนิดหนึ่งที่เรียกว่ากรด mycolic เหล่านี้มีลักษณะโซ่ยาวมาก.
เมื่อกรดไขมันมีโครงสร้างที่ยาวมากพวกเขาสามารถเก็บสีย้อมได้ง่ายขึ้น แบคทีเรียบางชนิดนั้นยากต่อการย้อมด้วย Gram stain เนื่องจากมีปริมาณกรด mycolic สูงของผนังเซลล์.
ในคราบ Ziehl-Neelsen จะใช้สารประกอบฟีนอลิกคาร์โบลฟูชสินซึ่งเป็นสีย้อมพื้นฐาน สิ่งนี้มีความสามารถในการโต้ตอบกับกรดไขมันของผนังเซลล์ซึ่งเป็นเนื้อข้าวเหนียวที่อุณหภูมิห้อง.
การย้อมสี Carbol fuchsin ได้รับการปรับปรุงในที่ที่มีความร้อนเนื่องจากขี้ผึ้งละลายและโมเลกุลของสีย้อมจะเคลื่อนที่อย่างรวดเร็วมากขึ้นในผนังเซลล์.
กรดที่ใช้ในภายหลังจะทำหน้าที่เปลี่ยนสีของเซลล์ที่ไม่เปื้อนเนื่องจากผนังของพวกมันไม่เกี่ยวข้องกับสีที่เพียงพอ ดังนั้นความแข็งแรงของตัวขจัดสีกรดจึงสามารถกำจัดสีย้อมกรดได้ เซลล์ที่ต้านทานการเปลี่ยนสีนี้เรียกว่าทนกรด.
สีรอง
หลังจากการเปลี่ยนสีของตัวอย่างนี้จะเปรียบเทียบกับสีย้อมอื่นที่เรียกว่าสีรอง มักใช้เมทิลีนสีน้ำเงินหรือมรกตสีเขียว.
สีย้อมทุติยภูมิวัสดุพื้นหลังและดังนั้นจึงสร้างความแตกต่างกับโครงสร้างที่ย้อมในขั้นตอนแรก เฉพาะเซลล์เปลี่ยนสีที่ดูดซับสีย้อมที่สอง (ป้องกันรอยเปื้อน) และใช้สีของพวกเขาในขณะที่เซลล์ที่ทนกรดรักษาสีแดง.
ขั้นตอนนี้มักใช้เพื่อระบุตัวตนของ วัณโรคมัยโคแบคทีเรีย และ Mycobacterium leprae, ซึ่งเรียกว่าบาซิลลีที่เป็นกรดเร็ว.
น้ำยา
ระบายสีเบื้องต้น
ใช้ Carboxin 0.3% fuchsin (กรองแล้ว) สีย้อมนี้เตรียมจากส่วนผสมของแอลกอฮอล์: ฟีนอลในเอทานอล (90%) หรือเมทานอล (95%) และในส่วนผสมนี้ฟิวซินพื้นฐาน 3 กรัมละลาย.
แก้ปัญหาการลดสี
ในขั้นตอนนี้คุณสามารถใช้สารละลายกรดแอลกอฮอล์ 3% หรือกรดซัลฟูริก 25%.
สีรอง (สีต่อต้าน)
สีย้อมที่ใช้กันมากที่สุดในการแสดงความคมชัดในตัวอย่างมักจะเป็นเมทิลีนสีน้ำเงิน 0.3% อย่างไรก็ตามคนอื่น ๆ ยังสามารถใช้เช่นสีเขียวมรกต 0.5%.
เทคนิค
ขั้นตอนการย้อมสีด้วยกรดอย่างรวดเร็ว
เตรียมรอยเปื้อนแบคทีเรีย
การเตรียมการนี้ทำบนสไลด์ที่สะอาดและแห้งตามข้อควรระวังในการฆ่าเชื้อ.
ทำให้รอยเปื้อนแห้ง
อนุญาตให้ smear แห้งที่อุณหภูมิห้อง.
ความร้อนตัวอย่าง
ตัวอย่างจะต้องได้รับความร้อนโดยการใช้ไฟบนสไลด์ด้านล่าง การตรึงด้วยแอลกอฮอล์สามารถทำได้เมื่อ smear ไม่ได้ถูกเตรียมด้วยเสมหะ (รักษาด้วยโซเดียมไฮโปคลอไรต์เพื่อขาว) และถ้ามันจะไม่ถูกย้อมทันที.
M. วัณโรค มันถูกกำจัดด้วยสารฟอกขาวและในระหว่างกระบวนการย้อมสี การทำเสมหะที่ไม่ผ่านการบำบัดจะไม่ฆ่า M. วัณโรค, ในขณะที่การตรึงด้วยแอลกอฮอล์เป็นแบคทีเรีย.
ครอบคลุมคราบ
คราบถูกปกคลุมไปด้วยวิธีการแก้ปัญหา carbol fuchsin (คราบพื้นฐานหลัก).
ความร้อนรอยเปื้อน
เสร็จประมาณ 5 นาที คุณควรสังเกตการปล่อยไอ (ประมาณ 60 ° C) มันเป็นสิ่งสำคัญที่จะไม่ทำให้ร้อนมากเกินไปและหลีกเลี่ยงการเผาตัวอย่าง.
สำหรับการทำความร้อนของคราบจะต้องระมัดระวังเป็นพิเศษเมื่อให้ความร้อนกับ fuchsin carbol โดยเฉพาะอย่างยิ่งถ้าทำการย้อมสีบนถาดหรือภาชนะอื่น ๆ ที่เก็บสารเคมีที่ติดไฟได้สูงจากคราบก่อนหน้านี้.
ควรใช้เปลวไฟเล็ก ๆ ใต้สไลด์โดยใช้หลอดไฟที่ชุบด้วยแอลกอฮอล์แอลกอฮอลล์เมทานอลหรือเอทานอล 70% หลีกเลี่ยงการใช้ไม้กวาดขนาดใหญ่ที่แช่ในเอทานอลเนื่องจากเป็นอันตรายจากไฟไหม้.
ล้างคราบ
ควรล้างด้วยน้ำสะอาด หากน้ำประปาไม่สะอาดให้ล้างป้ายด้วยน้ำที่ผ่านการกรองหรือกลั่นตามความเหมาะสม.
ครอบคลุม smear ด้วยแอลกอฮอล์กรด
แอลกอฮอล์กรดนี้ควรอยู่ที่ 3% ความคุ้มครองจะดำเนินการเป็นเวลา 5 นาทีหรือจนกว่ารอยเปื้อนจะเปลี่ยนสีเพียงพอนั่นคือสีชมพูอ่อน.
จะต้องคำนึงถึงว่าแอลกอฮอล์ที่เป็นกรดนั้นติดไฟได้ ดังนั้นจึงต้องใช้อย่างระมัดระวัง หลีกเลี่ยงการอยู่ใกล้แหล่งกำเนิดประกายไฟ.
ล้างคราบ
ควรซักด้วยน้ำสะอาดและน้ำกลั่น.
ปิดบังรอยเปื้อนด้วยสีย้อม
มันอาจเป็นสีเขียวมรกต (0.5%) หรือสีย้อมเมทิลีนสีน้ำเงิน (0.3%) เป็นเวลา 1 หรือ 2 นาทีโดยใช้เวลานานที่สุดถ้ารอยเปื้อนบาง.
ล้างคราบ
ต้องใช้น้ำสะอาดอีกครั้ง (กลั่น).
ท่อระบายน้ำ
ควรทำความสะอาดด้านหลังของแผ่นสไลด์และวางคราบบนหิ้งระบายน้ำเพื่อให้แห้งด้วยอากาศ (อย่าใช้กระดาษดูดซับสำหรับทำแห้ง).
ตรวจสอบรอยเปื้อนในกล้องจุลทรรศน์
ควรใช้วัตถุประสงค์ 100X และน้ำมันแช่ สแกนป้ายอย่างเป็นระบบและจดบันทึกข้อสังเกตที่เกี่ยวข้อง.
ตีความผลลัพธ์
ในทางทฤษฎีจุลินทรีย์ที่ย้อมสีแดงถือว่าเป็นกรดบวกเร็ว (AAR +).
ในทางตรงกันข้ามถ้าจุลินทรีย์มีสีย้อมสีน้ำเงินหรือสีเขียวขึ้นอยู่กับสีย้อมที่ใช้เป็นสีย้อมพวกเขาจะถือว่ากรดลบแอลกอฮอล์ทนลบ (AAR-).
การอ้างอิง
- Apurba, S. & Sandhya, B. (2016). สาระสำคัญของจุลชีววิทยาเชิงปฏิบัติ (ฉบับที่ 1) สำนักพิมพ์ Jaypee Brothers.
- Bauman, R. (2014). จุลชีววิทยากับโรคโดยระบบร่างกาย (ฉบับที่ 4). เพียร์สันการศึกษา, Inc.
- มรดกโลก, J. , Evans, E. & Killington, A. (1996). จุลชีววิทยาเบื้องต้น (ฉบับที่ 1) สำนักพิมพ์มหาวิทยาลัยเคมบริดจ์.
- Morello, J. , Granato, P. Wilson, M. & Morton, V. (2006). คู่มือห้องปฏิบัติการและสมุดงานด้านจุลชีววิทยา: การประยุกต์ใช้กับการดูแลผู้ป่วย (ฉบับที่ 11) การศึกษา McGraw-Hill.
- Vasanthakumari, R. (2007). ตำราวิชาจุลชีววิทยา (ฉบับที่ 1) B.I. สิ่งพิมพ์ PVT.


