มูลนิธิแกรมคราบวัสดุเทคนิคและการใช้งาน
กรัมคราบ เป็นเทคนิคการย้อมสีที่ง่ายและมีประโยชน์มากที่สุดในการวินิจฉัยจุลชีววิทยา เทคนิคนี้สร้างขึ้นโดยแพทย์ชาวเดนมาร์ก Hans Christian Gram ในปี 1884 ซึ่งสามารถจำแนกแบคทีเรียในแกรมบวกและแกรมลบตามองค์ประกอบของผนังเซลล์.
เทคนิคดังกล่าวได้รับการดัดแปลงบางอย่างโดย Hucker ในปี 1921 เพื่อรักษาเสถียรภาพของรีเอเจนต์และปรับปรุงคุณภาพของรอยเปื้อนเพื่อให้รอยเปื้อนแกรมเป็นที่รู้จักกันในชื่อแกรม - ฮัคเกอร์.
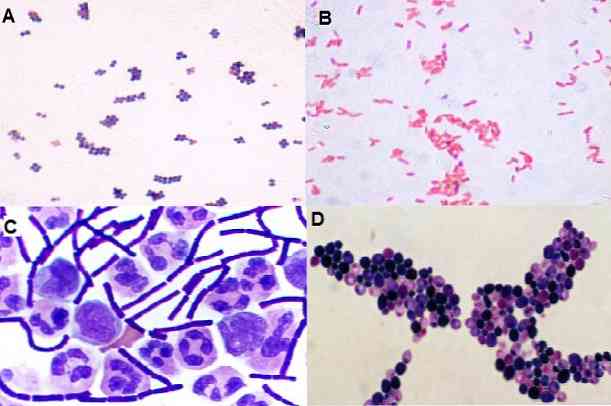
ด้วยเทคนิคนี้ยังเป็นไปได้ที่จะสังเกตเห็นรูปแบบที่จุลินทรีย์มีอยู่นั่นคือพวกมันคือ cocci, bacilli, coccobacilli, pleomorphic, filamentous และอื่น ๆ เช่นเดียวกับการกระจายในพื้นที่: ในคลัสเตอร์ในโซ่แยกเป็นคู่ใน tetrads ฯลฯ.
เมื่อสงสัยว่ามีการติดเชื้อแบคทีเรียตัวอย่างส่วนใหญ่ที่ได้รับควรแพร่กระจายบนภาพนิ่งและเปื้อนด้วยกรัมเพื่อตรวจสอบภายใต้กล้องจุลทรรศน์.
รายงานของกรัมจะแนะนำแพทย์เกี่ยวกับชนิดของเชื้อจุลินทรีย์ที่สามารถเป็นสาเหตุของการติดเชื้อก่อนที่จะได้รับผลสุดท้ายของพืช.
ในบางกรณีชีวิตของผู้ป่วยถูกทำลายอย่างมากดังนั้นแพทย์จึงต้องการรายงานแกรมอย่างเร่งด่วนเพื่อทำการรักษาเชิงประจักษ์ในขณะที่รอการระบุของจุลินทรีย์.
ตัวอย่างเช่นหากกรัมพบว่ามีกรัมบวก cocci ในน้ำไขสันหลังแพทย์จะปรับทิศทางการรักษาเบื้องต้นด้วยยาปฏิชีวนะที่กำจัดแบคทีเรียประเภทนี้ตามโปรโตคอลที่จัดตั้งขึ้นสำหรับมัน.
เมื่อผลสุดท้ายมาถึงด้วยชื่อของจุลินทรีย์ที่แยกได้และ antibiogram ของมันที่เกี่ยวข้องแพทย์จะประเมินว่าจะเปลี่ยนการรักษาด้วยหรือไม่ การตัดสินใจครั้งนี้จะทำตามการศึกษาความไวของจุลินทรีย์ต่อยาปฏิชีวนะที่ได้รับและวิวัฒนาการของผู้ป่วย.
ดัชนี
- 1 มูลนิธิ
- 2 วัสดุ
- 3 การเตรียมสีย้อมและรีเอเจนต์
- 3.1 Crystal violet solution
- 3.2 Iodo-Lugol
- 3.3 การฟอกสี
- 3.4 Contrast
- 4 การจัดเก็บรีเอเจนต์
- 5 การเตรียมการแพร่กระจายของตัวอย่างที่จะทำสี
- 5.1 -Gram ของตัวอย่างโดยตรง
- 5.2 -Gram of plants
- 6 เทคนิค
- 7 ยูทิลิตี้
- 8 ข้อผิดพลาดทั่วไป
- 9 อ้างอิง
มูลนิธิ
นี่คือเทคนิคที่นำเสนอ 4 ขั้นตอนพื้นฐาน: การย้อมสีการตรึงด้วยการเย้ยหยันการเปลี่ยนสีและการควบคุม ดังนั้นเทคนิคนี้นอกเหนือไปจากการระบายสีแบคทีเรีย.
คริสตัลสีม่วงเป็นสีแรกที่ใช้ มันมีความสัมพันธ์ที่ใกล้ชิดกับ peptidoglycan และสีม่วงจะทำให้แบคทีเรียทั้งหมดที่มีอยู่ติดอยู่นั้นจากนั้น lugol จะถูกวางไว้ซึ่งทำหน้าที่เป็น mordant นั่นคือมันจะทำให้เกิดการก่อตัวของคอมเพล็กซ์ที่ไม่ละลายน้ำของคริสตัล.
แบคทีเรียแกรมบวกที่มีผนังหนาของ peptidoglycan ก่อให้เกิดสารประกอบเชิงซ้อนมากขึ้น (คริสตัลไวโอเล็ต - ไอโอดีน) ดังนั้นพวกมันจึงคงสีย้อมไว้.
นอกจากนี้ยังมีอิทธิพลต่อผนังแบคทีเรียแกรมบวกที่มีปริมาณของกรดไม่อิ่มตัวที่มากขึ้นซึ่งแสดงถึงความสัมพันธ์ที่สูงสำหรับสารออกซิไดซ์ (Lugol).
ในขณะเดียวกันแบคทีเรียแกรมลบมีชั้นบาง ๆ ของ peptidoglycan ซึ่งทำให้แบคทีเรียซับซ้อนน้อยกว่าแบคทีเรียแกรมบวก.
จากนั้นมาถึงขั้นตอนของการเปลี่ยนสีซึ่งแบคทีเรียแกรมบวกและแกรมลบทำงานแตกต่างกัน.
แบคทีเรียแกรมลบมีเยื่อหุ้มชั้นนอกที่อุดมไปด้วย lipopolysaccharides ซึ่งเป็นส่วนหนึ่งของผนังเซลล์ ไขมันจะถูกทำลายโดยการสัมผัสกับแอลกอฮอล์อะซีโตนดังนั้นเยื่อหุ้มชั้นนอกจึงไม่คงที่จึงทำให้คริสตัลสีม่วงถูกปล่อยออกมา.
นี่คือวิธีที่มันจะถูกขัดจังหวะด้วย Safranin หรือ Fuchsin ขั้นพื้นฐานโดยใช้สีแดง.
ในกรณีของแบคทีเรียแกรมบวกพวกมันต่อต้านการเปลี่ยนสีเนื่องจากสารฟอกขาวทำหน้าที่ปิดรูขุมขนซึ่งป้องกันไม่ให้คริสตัลไวโอเลต / ไอโอดีนคอมเพล็กซ์หนีออกมา.
ดังนั้นการย้อมสีด้วยคริสตัลไวโอเล็ตจึงมีความเสถียรและไม่มีที่ว่างสำหรับ Safranin หรือ Fuchsin ด้วยเหตุนี้แบคทีเรียเหล่านี้จึงมีสีน้ำเงินหรือสีม่วงเข้ม.
วัสดุ
ชุดสีกรัมประกอบด้วย:
- คริสตัลสีม่วง
- Lugol
- แอลกอฮอล์อะซีโตน
- Safranin หรือ fuchsin ขั้นพื้นฐาน
การเตรียมสีย้อมและรีเอเจนต์
น้ำยาไวโอเล็ตคริสตัล
โซลูชัน A:
คริสตัลสีม่วง -2 กรัม
เอทิลแอลกอฮอล์ 95% -20cc
โซลูชัน B:
แอมโมเนียมออกซาเลต -0.8 กรัม
น้ำกลั่น -80 ซีซี
สำหรับการเตรียมคริสตัลสีม่วงขั้นสุดท้ายสารละลาย 1:10 ควรเจือจางด้วยน้ำกลั่นและผสมกับสารละลาย 4 ส่วน B จะถูกเก็บไว้เป็นเวลา 24 ชั่วโมงก่อนการใช้งาน มันถูกกรองในขวดสำหรับการย้อมสีอำพันโดยใช้ตัวกรองกระดาษ.
จำนวนเงินที่จะใช้ทุกวันจะถูกโอนไปยังขวดอำพันพร้อมหยด.
Iodo-Lugol
ชั่งน้ำหนักและวัดปริมาณที่ระบุของสารประกอบแต่ละชนิดดังนี้:
Crystals of Iodo --1gr
โพแทสเซียมไอโอไดด์ - 2gr
น้ำกลั่น -300 ซีซี
โพแทสเซียมไอโอไดด์จะละลายในน้ำทีละน้อยแล้วจึงเติมไอโอดีน วิธีการแก้ปัญหาคือโกนให้กับขวดสีอำพัน.
จำนวนเงินที่จะใช้ทุกวันจะถูกโอนไปยังขวดอำพันขนาดเล็กที่มีหยด.
การฟอกสี
เอธิลแอลกอฮอล์ 95% -50 มล
อะซิโตน - 50 มล
มันถูกจัดทำขึ้นในส่วนเท่า ๆ กัน ครอบคลุมดีก็มีแนวโน้มที่จะระเหย.
วางในขวดที่มีหยด.
การเตรียมนี้ให้การเปลี่ยนสีในเวลาปานกลาง 5-10 วินาทีและเป็นที่แนะนำมากที่สุด.
ผู้เริ่มต้นต้องการใช้เอทิลแอลกอฮอล์เพียง 95% ซึ่งการเปลี่ยนสีจะช้าลงจาก 10 ถึง 30 วินาที.
ในขณะที่ผู้มีประสบการณ์มากที่สุดสามารถใช้อะซิโตนบริสุทธิ์ซึ่งการเปลี่ยนสีเกิดขึ้นอย่างรวดเร็วจาก 1 ถึง 5 วินาที.
ความแตกต่าง
โซลูชันหุ้นของ Safranin
Safranina -2.5 gr
เอทิลแอลกอฮอล์ 95% -100 ซีซี
หลังจากชั่งน้ำหนักปริมาณที่ระบุของ Safranin ละลายใน 100 ซีซีของเอทิลแอลกอฮอล์ถึง 95%.
โซลูชัน Safranin ที่ใช้งานได้ถูกจัดทำขึ้นจากโซลูชันสต็อค.
ในการทำเช่นนี้วัดสารละลายสต็อก 10 ซีซีเพิ่มน้ำกลั่น 90 ซีซีเพื่อให้สมบูรณ์ 100 มล.
ขอแนะนำให้ถ่ายโอนจำนวนเงินที่จะใช้ทุกวันไปยังขวดสีเหลืองอำพันที่มีหยด.
จุลินทรีย์ที่มีรอยเปื้อนอย่างอ่อนแกรมลบกับรอยเปื้อนแกรม - ฮัคเกอร์เช่นแอนแอโรบิกบางตัว, Legionella sp, Campylobacter sp และ Brucella sp, พวกมันสามารถย้อมได้ดีกว่ามากหากการดัดแปลงที่ทำโดย Kopeloff เป็น Gram-Hucker staining เรียกว่า stam Gram-Kopeloff ใช้.
เทคนิคนี้เปลี่ยนสีย้อม Safranin โดย fuchsin ขั้นพื้นฐาน ด้วยการดัดแปลงนี้จะทำให้สีของจุลินทรีย์ดังกล่าวมีประสิทธิภาพ.
การจัดเก็บรีเอเจนต์
สีย้อมที่เตรียมไว้ควรเก็บไว้ที่อุณหภูมิห้อง.
การเตรียมการแพร่กระจายตัวอย่างเป็นสี
ตัวอย่างต้องมีอย่างน้อย 105 จุลินทรีย์ก่อนการสังเกตของจุลินทรีย์ในสเมียร์อาจเป็นไปได้ สเปรดสามารถทำจากตัวอย่างโดยตรงหรือวัฒนธรรมในสื่อที่เป็นของแข็งหรือของเหลว.
สเปรดควรสม่ำเสมอกระจายอย่างดีและไม่หนาเกินไปเพื่อให้มองเห็นโครงสร้างที่ดีขึ้น.
-ตัวอย่างโดยตรงกรัม
กรัมปัสสาวะโดยไม่ต้อง centrifuge
ปัสสาวะผสมและ 10 ไมโครลิตรถูกวางไว้บนภาพนิ่ง การสังเกตอย่างน้อยหนึ่งฟิลด์ของแบคทีเรีย / เขตแช่แสดงว่ามีการติดเชื้อ.
ซึ่งหมายความว่าวัฒนธรรมจะมีมากกว่า 100,000 CFU / ml (10)5 CFU / มล.) ของปัสสาวะใน 85% ของกรณี.
วิธีนี้ไม่เป็นประโยชน์สำหรับการนับจำนวนอาณานิคมที่ต่ำกว่า 100,000 CFU.
LCR กรัม
CSF ควรหมุนเหวี่ยง, ส่วนเหนือออกและเม็ดกระจายไปบนภาพนิ่ง ของเหลวนี้ปลอดเชื้อภายใต้สภาวะปกติ การสังเกตแบคทีเรียบ่งชี้ว่ามีการติดเชื้อ.
ตัวอย่างกรัมของระบบทางเดินหายใจ
เสมหะแกรมล้างหลอดลมหรือหลอดลมล้างปอดถึงแม้อาจมีความหลากหลายของจุลินทรีย์มักจะเป็นแนวทางในการวินิจฉัยนอกเหนือจากการเป็นประโยชน์ประเภทของเซลล์ที่สังเกต.
ในกรณีของเสมหะควรเตรียมสเมียร์ด้วยตัวอย่างที่มีหนองมากที่สุด.
สตูลกรัม
ไม่แนะนำให้ใช้งาน Gram กับตัวอย่างประเภทนี้เนื่องจากไม่มีค่าการวินิจฉัย.
-พืชแกรม
พวกเขาสามารถทำได้สองวิธีหนึ่งจากพืชที่เป็นของเหลวและอื่น ๆ จากพืชที่เป็นของแข็ง.
พืชน้ำ
จากวัฒนธรรมของเหลวนั้นง่ายมาก ภายใต้น้ำหนักเบาของน้ำซุปที่ขุ่นขุ่นจะถูกนำไปวางไว้บนสไลด์ที่แห้งและสะอาดทำให้เกิดการเคลื่อนที่เป็นวงกลมจากจุดศูนย์กลางไปยังขอบเพื่อกระจายวัสดุอย่างสม่ำเสมอ.
ได้รับอนุญาตให้แห้งตามธรรมชาติในอากาศ เมื่อแห้งวัสดุจะถูกจับจ้องไปที่แผ่นด้วยความร้อน สำหรับสิ่งนี้ด้วยความช่วยเหลือของตัวหนีบแผ่น 3 จะถูกส่งผ่าน 4 ครั้งผ่านเปลวไฟของเครื่องเผาไหม้แผดเผาระวังไม่ให้เผาวัสดุ.
แผ่นที่ได้รับอนุญาตให้เย็นและวางบนสะพานระบายสี.
พืชที่เป็นของแข็ง
หากต้องการทำการขยายแกรมคราบจากวัฒนธรรมที่มั่นคงให้ดำเนินการดังนี้:
ก่อนที่จะเลือกอาณานิคมที่จะต้องดำเนินการสไลด์ควรเตรียมวางสองหยดประมาณของน้ำเกลือทางสรีรวิทยาหมัน.
หากแผ่นวัฒนธรรมดั้งเดิมมีโคโลนีหลายประเภทโคโลนีที่แยกได้ของแต่ละอันจะถูกเลือกให้ทำงานเป็นแกรม แต่ละกลุ่มจะถูกนำมาพร้อมกับห่วงทองคำขาวเพื่อละลายในสารละลายน้ำเกลือที่วางไว้ก่อนหน้านี้บนสไลด์.
มีการเคลื่อนที่เป็นวงกลมจากกึ่งกลางไปยังรอบนอกเพื่อกระจายโคโลนีให้เป็นเนื้อเดียวกันบนสไลด์.
ได้รับอนุญาตให้แห้งตามธรรมชาติในอากาศ เมื่อแผ่นเหล็กแห้งด้วยความร้อนตามที่อธิบายไว้ข้างต้น (เผาแผ่นกระดาษด้วยไฟแช็ก) ระวังอย่าให้วัสดุไหม้.
ขั้นตอนนี้จะต้องดำเนินการกับอาณานิคมแต่ละประเภทที่แตกต่างกัน ควรจดบันทึกคำสั่งของผู้สังเกตการณ์ลงบนแผ่นกระดาษเช่น:
โคโลนี 1: อาณานิคมเบต้าเบมิโลเฮติสีเหลือง: cocci บวกแกรมถูกพบในกลุ่ม
อาณานิคม 2: ครีมโคโลนีโดยไม่ต้องมีภาวะเม็ดเลือดแดงแตก: พบ coccobacilli กรัมลบ.
แต่ละแผ่นจะต้องมีป้ายกำกับเพื่อทราบว่าเรากำลังเฝ้าสังเกต.
เทคนิค
เทคนิคการย้อมสีกรัมเป็นเรื่องง่ายมากที่จะดำเนินการและราคาไม่แพงและไม่ควรพลาดในห้องปฏิบัติการจุลชีววิทยา.
ทำแบบเดียวกันดังนี้:
- แก้ไขรอยเปื้อนด้วยความร้อนและวางบนสะพานสี.
- แผ่นถูกปกคลุมอย่างสมบูรณ์ด้วยแก้วสีม่วงเป็นเวลา 1 นาที.
- ล้างด้วยน้ำ ห้ามตากแห้ง
- ปิดฝาจานด้วยสารละลาย Lugol ทิ้งไว้ 1 นาที ล้างด้วยน้ำ ห้ามตากแห้ง.
- ผสมประมาณ 5-10 วินาทีด้วยความปั่นป่วนเบา ๆ ในอะซิโตนแอลกอฮอล์ หรือวางแผ่นให้อยู่ในตำแหน่งตั้งตรงและหยดหยดสารลดสีลงบนพื้นผิวจนกว่าแก้วสีม่วงที่เหลือจะถูกลากออกไป อย่าเกิน.
- ล้างด้วยน้ำ ห้ามตากแห้ง.
- แทนที่แผ่นบนสะพานสีและครอบคลุมเป็นเวลา 30 วินาทีด้วย safranin (Gram-Hucker) หรือ 1 นาทีด้วย fuchsin พื้นฐาน (Gram-Kopeloff).
- ล้างด้วยน้ำ
- อนุญาตให้แห้งตามธรรมชาติในอากาศแนวตั้ง.
เมื่อแห้งให้วางน้ำมันแช่ 1 หยดเพื่อสังเกตภายใต้วัตถุประสงค์ 100X ในกล้องจุลทรรศน์ออปติคัล.
ประโยชน์
เทคนิคนี้ช่วยให้สามารถแยกแยะความแตกต่าง morphotypeintial ของแบคทีเรียส่วนใหญ่.
ยีสต์ยังมีความโดดเด่นด้วยสีนี้ พวกเขาใช้คริสตัลสีม่วงนั่นคือพวกเขาเปื้อนแกรมบวก.
ในทางกลับกันแบคทีเรียที่ก่อตัวเป็นสปอร์ของแกรมบวกสามารถแยกออกได้ซึ่งสังเกตเห็นพื้นที่ที่ชัดเจนภายในบาซิลลัสที่ซึ่ง endospore ก่อตัวขึ้นแม้ว่าสปอร์จะไม่ดี ในการใช้สปอร์จะใช้เทคนิคอื่น ๆ เช่น Shaeffer-Fulton.
ควรสังเกตว่าคราบนี้ไม่ได้ให้สีแบคทีเรียทุกชนิดนั่นคือมีกรณีที่การย้อมสีไม่ทำงาน.
ในกรณีนี้สามารถพูดถึงแบคทีเรียที่ไม่มีผนังเซลล์ ตัวอย่างเช่นสกุล Mycoplasma, Spheroplasts, Ureaplasma, L-forms และ protoplasts.
มันยังสามารถกำจัดแบคทีเรียที่ไม่ดีที่มีผนังซึ่งอุดมไปด้วยกรด mycolic เช่น Mycobacteria และแบคทีเรียในเซลล์เช่น Chlamydias และ Rickettsias.
นอกจากนี้ยังไม่มีประสิทธิภาพในการยับยั้งเชื้อแบคทีเรียสไปโรคีทัลส่วนใหญ่.
มีแบคทีเรียประเภทเดียวกันที่สามารถสังเกตได้ในตัวอย่างเดียวกับกรัมบวกและลบกรัม เมื่อสิ่งนี้เกิดขึ้นเรียกว่าตัวแปรแกรมสเปรย์ซึ่งอาจเกิดจากการเปลี่ยนแปลงของสารอาหารอุณหภูมิ pH หรือความเข้มข้นของอิเล็กโทรไลต์.
ข้อผิดพลาดทั่วไป
ฟอกขาวมากเกินไป
การพูดเกินจริงในขั้นตอนการเปลี่ยนสีอาจทำให้เกิดการสังเกตของจุลินทรีย์แกรมลบปลอม.
อย่ารอเวลาที่จะทำให้แห้งพอที่จะเพิ่มน้ำมันแช่:
ข้อผิดพลาดนี้ทำให้เกิดการสะสมของไมเซลล์ไขมันที่ทำให้สังเกตโครงสร้างปัจจุบันได้ยาก สิ่งนี้จะเกิดขึ้นเมื่อน้ำมันรวมโมเลกุลของน้ำเข้ากับสเมียร์.
กลับคำสั่งของรีเอเจนต์:
ข้อผิดพลาดเช่นนี้จะทำให้แบคทีเรียแกรมลบแสดงสีม่วงนั่นคือแกรมบวกปลอม.
ใช้พืชเก่า (ของแข็งหรือของเหลว):
มันสามารถทำให้เกิดแบคทีเรียแกรมบวกที่จะลบแกรมลบ (เท็จลบแกรม) สิ่งนี้เกิดขึ้นเพราะในวัฒนธรรมเก่าแก่มีโอกาสเป็นไปได้ว่ามีแบคทีเรียที่ตายหรือเสื่อมสภาพและภายใต้เงื่อนไขเหล่านี้แบคทีเรียจะไม่รักษาคริสตัลไวโอเล็ต.
ใช้วิธีการแก้ปัญหา Lugol เก่ามาก:
เมื่อเวลาผ่านไปลูโกลจะสูญเสียคุณสมบัติและสีของมันจางหายไป หากใช้น้ำยาที่เสื่อมสภาพไปแล้วจะไม่สามารถแก้ไขคริสตัลไวโอเล็ตได้เป็นอย่างดีดังนั้นจึงมีความเป็นไปได้ที่จะได้รับการสร้างภาพของจุลินทรีย์ที่เป็นเท็จตลบแกรม.
พื้นหลังสีน้ำเงิน
พื้นหลังที่เปลี่ยนสีได้อย่างเหมาะสมจะเป็นสีแดง พื้นหลังสีน้ำเงินแสดงว่าการเปลี่ยนสีไม่เพียงพอ.
การอ้างอิง
- Ryan KJ, Ray C. 2010. sherris. จุลชีววิทยา การแพทย์รุ่นที่ 6 McGraw-Hill นิวยอร์กสหรัฐอเมริกา
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004) การวินิจฉัยทางจุลชีววิทยา (ฉบับที่ 5) อาร์เจนตินา, Panamericana บรรณาธิการ.
- Forbes B, Sahm D, Weissfeld A. 2009. การวินิจฉัยทางจุลชีววิทยาของ Bailey & Scott 12 เอ็ด อาร์เจนตินา Panamericana S.A บทบรรณาธิการ
- Casas-Rincón G. 1994. เห็ดราทั่วไป 2nd Ed. Universidad Central de Venezuela, Editions Library เวเนซุเอลาการากัส.
- "กรัมคราบ" Wikipedia, สารานุกรมฟรี. 4 ต.ค. 2018, 23:40 UTC 9 ธ.ค. 2018, 17:11 นำมาจาก es.wikipedia.org.
- González M, González N. 2011. คู่มือการใช้จุลชีววิทยาทางการแพทย์ 2nd edition, Venezuela: คณะกรรมการสื่อและสิ่งพิมพ์ของ University of Carabobo.
- López-Jácome L, Hernández-Durán M, Colín-Castro C, Ortega-Peña S, Cerón-González G, Franco-Cendejas F. การย้อมสีพื้นฐานในห้องปฏิบัติการจุลชีววิทยา. งานวิจัยด้านคนพิการ 2014; 3 (1): 10-18.


