รากฐานการย้อมสีสปอร์เทคนิคและการใช้งาน
สปอร์การย้อมสี เป็นวิธีการที่ใช้ในการสร้างสีโครงสร้างความต้านทานที่ก่อให้เกิดแบคทีเรียบางชนิดเมื่ออยู่ในสภาพที่ไม่เอื้ออำนวย โครงสร้างเหล่านี้สอดคล้องกับวิธีการเอาชีวิตรอด.
มีหลายจำพวกที่สร้างสปอร์ อย่างไรก็ตามสิ่งที่สำคัญคือ Bacillus และ Clostridium จำพวกนี้ถือว่ามีความเกี่ยวข้องมากกว่าเพราะมีสายพันธุ์ที่ทำให้เกิดโรคสำหรับมนุษย์.
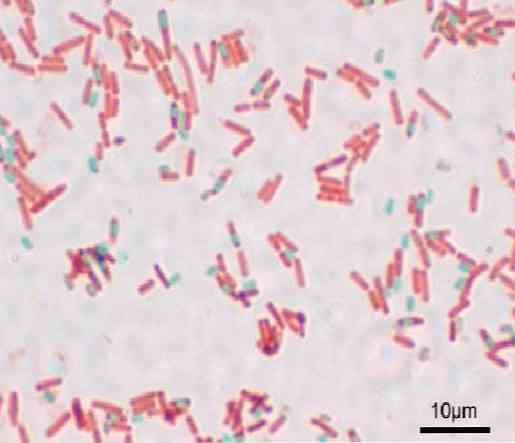
บาซิลลัสแต่ละชนิดสามารถก่อให้เกิดสปอร์ได้ ในช่วงเวลาของการย้อมสีการเตรียมสปอร์สามารถพบได้ในบาซิลลัส (endospore) หรือนอกมัน (exospore) ด้วยเทคนิคการย้อมสีแบบดั้งเดิมสำหรับแบคทีเรีย - เช่นสแกรมคราบ - สปอร์ยังคงไม่มีสี.
ในปัจจุบันมีหลายวิธีการระบายสีที่สามารถข้ามโครงสร้างหนาของสปอร์เพื่อย้อมมัน วิธีการเหล่านี้มีความหลากหลายมาก ในบรรดาสิ่งเหล่านี้เราสามารถพูดถึงเทคนิค Dorner, คราบMöellerและวิธีการ Shaeffer-Fulton หรือที่เรียกว่า Wirtz-Conklin.
จากเทคนิคทั้งหมดที่กล่าวถึงวิธีการของ Shaeffer-Fulton นั้นถูกใช้มากที่สุดในห้องปฏิบัติการตามปกติ มันเป็นชื่อของนักจุลชีววิทยาสองคนที่สร้างสีขึ้นในปี 1930: Alicia Shaeffer และ MacDonald Fulton อย่างไรก็ตามบางครั้งเทคนิคนี้เรียกว่า Wirtz-Conklin เพื่อเป็นเกียรติแก่นักแบคทีเรียวิทยาสองคนในปี 1900.
ดัชนี
- 1 มูลนิธิ
- 2 เทคนิคการระบายสีสปอร์
- 2.1 เทคนิคของ Dorner
- 2.2 เทคนิคการแก้ไข Dorner
- 2.3 เทคนิคของ Shaeffer-Fulton หรือ Wirtz-Conklin
- 2.4 เทคนิคของMöeller
- 2.5 เทคนิคMöellerดัดแปลงโดยไม่มีความร้อน
- 3 ใช้
- 3.1 ตัวอย่าง
- 4 อ้างอิง
มูลนิธิ
สปอร์ไม่เปื้อนด้วยสีธรรมดาเพราะมีผนังหนามาก องค์ประกอบที่ซับซ้อนของสปอร์ป้องกันไม่ให้เข้าสู่สีย้อมส่วนใหญ่.
หากมีการศึกษาสปอร์จากด้านนอกสู่ด้านในจะสังเกตเห็นชั้นต่อไปนี้: ประการแรกคือ exosporium ซึ่งเป็นชั้นนอกที่บางที่สุดที่เกิดจาก glycoproteins.
จากนั้นหนังกำพร้าซึ่งให้ความต้านทานต่ออุณหภูมิสูงตามมาด้วยเยื่อหุ้มสมองประกอบด้วย peptidoglycan จากนั้นก็มีกำแพงของฐานที่ป้องกันโปรโตพลาสต์.
สปอร์เป็นโครงสร้างที่ขาดน้ำซึ่งประกอบด้วยแคลเซียม 15% และกรดดิติโคลินิก ดังนั้นเทคนิคการระบายสีสปอร์ส่วนใหญ่จึงขึ้นอยู่กับการประยุกต์ใช้ความร้อนเพื่อให้สีย้อมสามารถเจาะโครงสร้างที่หนา.
เมื่อสปอร์ย้อมแล้วจะไม่สามารถกำจัดสีย้อมได้ ในเทคนิค Shaeffer-Fulton, มาลาไคต์กรีนเข้าสู่เซลล์พืชและเมื่อใช้ความร้อนจะแทรกซึมเข้าไปในเอ็นโดสปอร์และภายนอก.
เมื่อล้างด้วยน้ำสีย้อมจะถูกลบออกจากเซลล์พืช สิ่งนี้เกิดขึ้นเนื่องจากสีย้อมมาลาไคต์สีเขียวเป็นพื้นฐานเล็กน้อยจึงผูกติดกับเซลล์พืชอย่างอ่อน.
ในทางตรงกันข้ามมันไม่สามารถหลุดออกจากสปอร์ได้และในที่สุดบาซิลลัสกับซารานินก็ต่างจากกัน รากฐานนี้ใช้ได้สำหรับเทคนิคที่เหลือซึ่งมีบางสิ่งคล้ายกันเกิดขึ้น.
เทคนิคการระบายสีสปอร์
ในการทำให้สปอร์เปื้อนคุณต้องมีวัฒนธรรมที่บริสุทธิ์ของสายพันธุ์ต้องสงสัยที่คุณต้องการศึกษา.
วัฒนธรรมต้องอยู่ภายใต้อุณหภูมิที่สูงเป็นเวลา 24 ชั่วโมงเพื่อกระตุ้นให้จุลินทรีย์สร้างสปอร์ ด้วยเหตุนี้วัฒนธรรมสามารถวางไว้ในเตาอบที่ 44 ° C หรือในตู้เย็น (8 ° C) เป็นเวลา 24 หรือ 48 ชั่วโมง.
หากเหลือเวลามากเกินไปที่อุณหภูมิที่กล่าวถึงจะมีการสังเกตเอกซ์ปอร์เท่านั้นเนื่องจากเอนโดสปอร์ทั้งหมดจะออกจากบาซิลลัส.
ในตอนท้ายของเวลาควรวางสารละลายทางสรีรวิทยาที่ผ่านการฆ่าเชื้อแล้วสองสามหยดลงบนภาพนิ่งที่สะอาด จากนั้นส่วนเล็ก ๆ ของพืชจะถูกถ่ายและทำการแพร่กระจายอย่างละเอียด.
หลังจากนั้นปล่อยทิ้งไว้ให้แห้งก็จะถูกจับจ้องไปที่ความร้อนและย้อมด้วยเทคนิคบางอย่างที่อธิบายไว้ด้านล่าง:
เทคนิคของ Dorner
1- เตรียมหลอดทดลองแขวนลอยเข้มข้นของจุลินทรีย์ที่มีสปอร์ในน้ำกลั่นแล้วเติม Kinyoun ฟีนอลิกฟิชชันในปริมาณเท่ากัน.
2- วางหลอดในอ่างด้วยน้ำเดือดประมาณ 5 ถึง 10 นาที.
3- บนสไลด์ที่สะอาดให้ผสมการลดลงของการระงับก่อนหน้านี้กับการลดลงของสารละลายน้ำนิกrosine 10% ต้มและกรอง.
4- ขยายและแห้งอย่างรวดเร็วด้วยความร้อนอ่อน.
5- ตรวจสอบด้วยวัตถุประสงค์ 100X (การแช่).
สปอร์สีแดงเปื้อนและเซลล์แบคทีเรียปรากฏเกือบไม่มีสีกับพื้นหลังสีเทาเข้ม.
เทคนิคการแก้ไข Dorner
1- การแขวนลอยของจุลินทรีย์ที่มีสปอร์กระจายอยู่บนภาพนิ่งและจับจ้องไปที่ความร้อน.
2- ตัวอย่างถูกปกคลุมด้วยแถบกระดาษกรองซึ่งจะถูกเพิ่มกรด fenic fuchsin สีย้อมจะถูกทำให้ร้อนประมาณ 5 ถึง 7 นาทีด้วยเปลวไฟของเครื่องเผาแผดเผาจนกระทั่งปล่อยไอระเหยออกมา จากนั้นนำกระดาษออก.
3- ล้างเตรียมด้วยน้ำแล้วเช็ดให้แห้งด้วยกระดาษดูดซับ.
4- ปกคลุม smear ด้วยฟิล์มบาง ๆ ของ nigrosin 10% โดยใช้สไลด์ที่สองเพื่อกระจาย nigrosin หรือเข็ม.
สีที่ถ่ายโดยสปอร์และแบคทีเรียนั้นเหมือนกับที่อธิบายไว้ในศิลปะก่อนหน้านี้.
เทคนิค Shaeffer-Fulton หรือ Wirtz-Conklin
1- ทำให้บางกระจายด้วยการระงับของจุลินทรีย์ sporulated บนภาพนิ่งและแก้ไขให้ร้อน.
2- ปิดฝาสไลด์ด้วยสารละลายน้ำสีเขียวมรกต 5% (สามารถใส่กระดาษกรองลงบนแผ่นกระดาษได้).
3- ความร้อนบนเปลวไฟของเครื่องเผาแผดเผาที่จะทำให้ไอน้ำที่จะหลบหนีและลบเปลวไฟ ทำซ้ำการดำเนินการเป็นเวลา 6 ถึง 10 นาที หากในระหว่างขั้นตอนการแก้ปัญหาสีเขียวมรกตที่ระเหยไปมากเกินไปสามารถเพิ่มมากขึ้น.
4- นำกระดาษกรองออก (ถ้าวางไว้) แล้วล้างด้วยน้ำ.
5- ปิดฝาสไลด์ด้วย 0.5% น้ำ Safranin เป็นเวลา 30 วินาที (บางสายพันธุ์ของเทคนิคใช้ Safranin น้ำ 0.1% และทิ้งไว้ 3 นาที).
ด้วยเทคนิคนี้สปอร์เป็นสีเขียวและแบคทีเรียเป็นสีแดง.
มันมีข้อเสียที่ endospores ของวัฒนธรรมหนุ่มสาวไม่ดีเพราะพวกเขาดูชัดเจนมากหรือไม่มีสี เพื่อหลีกเลี่ยงปัญหานี้ขอแนะนำให้ใช้วัฒนธรรมการฟักตัว 48 ชั่วโมง.
เทคนิคMöeller
1- ครอบคลุม smear ด้วยคลอโรฟอร์มเป็นเวลา 2 นาที.
2- ทิ้งคลอโรฟอร์ม.
3- ปกคลุมด้วยกรด chromic 5% เป็นเวลา 5 นาที.
4- ล้างด้วยน้ำกลั่น
5- แผ่นถูกปกคลุมด้วยปลาคาร์พฟิวซิน - ฟีนอลและสัมผัสกับเปลวไฟของเครื่องเผาแผดเผาจนปล่อยไอระเหย; จากนั้นจะถูกลบออกจากเปลวไฟสักครู่ การดำเนินการซ้ำจนกระทั่งถึง 10 นาที.
6- ล้างด้วยน้ำ.
7- ใช้เอทานอลที่เป็นกรด (แอลกอฮอล์ไฮโดรคลอริก) เพื่อลดสี เหลือเวลาอีก 20 หรือ 30 วินาที.
8- ล้างด้วยน้ำกลั่น.
9- Counteract ครอบคลุมแผ่นด้วยเมทิลีนบลูเป็นเวลา 5 นาที.
10- ล้างด้วยน้ำกลั่น.
11- ปล่อยทิ้งไว้ให้แห้งและนำตัวอย่างไปไว้ใต้กล้องจุลทรรศน์.
สปอร์ดูบาซิลลัสสีแดงและน้ำเงิน เป็นสิ่งสำคัญที่จะไม่สูดดมไอระเหยเนื่องจากเป็นพิษและในระยะยาวอาจเป็นสารก่อมะเร็ง.
เทคนิคMöellerดัดแปลงโดยไม่ใช้ความร้อน
ในปี 2550 Hayama และผู้ทำงานร่วมกันของเขาได้สร้างการดัดแปลงของเทคนิคMöeller พวกเขาลบขั้นตอนการให้ความร้อนของสีย้อมและแทนที่ด้วยการเติมสารลดแรงตึงผิว Tergitol 7 2 หยดต่อทุกๆ 10 มล. ของสารละลายฟูชชัน - ฟีนอลิกคาร์โบลิก ผลลัพธ์เดียวกันได้รับ.
การใช้งาน
สปอร์สีแสดงข้อมูลที่มีประโยชน์และมีประโยชน์มากสำหรับการระบุเชื้อโรคเนื่องจากการปรากฏตัวของมันรูปร่างตำแหน่งที่ตั้งอยู่ภายในบาซิลลัสและความสามารถในการทำให้เซลล์พืชผิดรูปหรือไม่นั้นเป็นข้อมูลที่สามารถชี้นำชนิด มีส่วนร่วมในเพศที่แน่นอน.
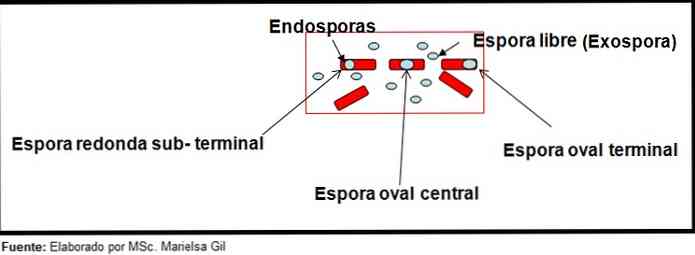
ในบริบทนี้มันเป็นมูลค่าการกล่าวขวัญว่าสปอร์สามารถกลมหรือรูปไข่พวกเขาสามารถอยู่ในศูนย์หรือใน paracentral, subterminal หรือตำแหน่งเทอร์มินัล.
ตัวอย่าง
- Clostridium difficile สร้างสปอร์รูปไข่ในตำแหน่งเทอร์มินัลที่ทำให้บาซิลลัสเปลี่ยนรูป.
- สปอร์ของ Clostridium tertium มันเป็นรูปวงรีไม่ทำให้เสียรูปบาซิลลัสและอยู่ที่ระดับเทอร์มินัล.
- endospore ของ Clostridium tetani มันเป็นขั้วและทำให้เสียรูปบาซิลลัสทำให้ลักษณะของไม้ตีกลอง.
- สปอร์ของ Clostridium botulinum, C. histolyticum, C. Novy และ C. septicum พวกเขาเป็นรูปไข่กลมหรือ subterminal และทำให้เสียรูปบาซิลลัส.
- endospore ของ Clostridium sordelli มันตั้งอยู่ในตำแหน่งกลางด้วยความผิดปกติเล็กน้อย.

การอ้างอิง
- Hayama M, Oana K, Kozakai T, Umeda S, Fujimoto J, Ota H, Kawakami Y. ข้อเสนอของเทคนิคที่ง่ายขึ้นสำหรับการย้อมสีสปอร์ของแบคทีเรียโดยไม่ต้องใช้วิธีการแก้ไขที่ประสบความสำเร็จของ Moeller Eur J Med Res. 2007; 16 12 (8): 356-9.
- ผู้มีส่วนร่วมใน Wikipedia Moeller เปื้อน Wikipedia, สารานุกรมเสรี UTC 3, 2018, 03:28 UTC วางจำหน่ายแล้วที่: en.wikipedia.org
- Pérez R, Juárez M, Rodríguez (2011) คู่มือปฏิบัติการเทคนิคทางจุลชีววิทยา ภาควิชาวิทยาศาสตร์พื้นฐานสถาบันจุลชีววิทยา สถาบันโพลีเทคนิคแห่งชาติ.
- "Endospore." Wikipedia, สารานุกรมฟรี. 25 ก.พ. 2018, 10:20 UTC 10 ม.ค. 2019, 02:42: en.wikipedia.org
- Silva L, Silva C, Fernández N, Bueno C, Torres J, Rico M, Macías J และผู้ทำงานร่วมกัน (2006) บุคลากรแรงงานของชุมชนปกครองตนเองของ Extremadura วาระที่เฉพาะเจาะจงเล่ม IV MAD บรรณาธิการ เซวิลล์ - สเปน, pp 211-212.
- Silva M, García M, Corrales J, Ponce E. (2006). ผู้เชี่ยวชาญด้านเทคนิคห้องปฏิบัติการ, จาก Galician Health Service (SERGAS) เนื้อหาเฉพาะเรื่อง 2. บรรณาธิการ MAD เซวิลล์ - สเปน, หน้า 79-80.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004) การวินิจฉัยทางจุลชีววิทยา (ฉบับที่ 5) อาร์เจนตินา, Panamericana บรรณาธิการ.
- Forbes B, Sahm D, Weissfeld A. 2009. การวินิจฉัยทางจุลชีววิทยาของ Bailey & Scott 12 เอ็ด อาร์เจนตินา Panamericana S.A บทบรรณาธิการ


