โครงสร้างแคลเซียมออกไซด์ (CaO) คุณสมบัติและการใช้งาน
แคลเซียมออกไซด์ (CaO) เป็นสารประกอบอนินทรีย์ที่มีแคลเซียมและออกซิเจนในรูปแบบไอออนิก (เพื่อไม่ให้สับสนกับแคลเซียมเปอร์ออกไซด์, CaO2) เป็นที่รู้จักกันทั่วโลกว่ามะนาวคำที่กำหนดสารประกอบอนินทรีย์ที่ประกอบด้วยคาร์บอเนตแคลเซียมออกไซด์และไฮดรอกไซด์รวมถึงโลหะอื่น ๆ เช่นซิลิกอนอลูมิเนียมและเหล็ก.
ออกไซด์ (หรือมะนาว) นี้เรียกว่า colloquially เป็นปูนขาวหรือปูนขาวขึ้นอยู่กับว่ามันจะชุ่มชื้นหรือไม่ มะนาวเป็นแคลเซียมออกไซด์ในขณะที่ปูนขาวคือไฮดรอกไซด์ ในทางกลับกันหินปูน (หินปูนหรือปูนขาว) เป็นหินตะกอนที่ประกอบด้วยแคลเซียมคาร์บอเนต (CaCO) เป็นส่วนใหญ่3).

มันเป็นหนึ่งในแหล่งธรรมชาติที่ใหญ่ที่สุดของแคลเซียมและถือเป็นวัตถุดิบสำหรับการผลิตแคลเซียมออกไซด์ ออกไซด์นี้ผลิตได้อย่างไร? คาร์บอเนตมีความอ่อนไหวต่อการสลายตัวเนื่องจากความร้อน ให้ความร้อนแคลเซียมคาร์บอเนตที่อุณหภูมิสูงกว่า 825 ° C นำไปสู่การก่อตัวของมะนาวและคาร์บอนไดออกไซด์.
คำสั่งข้างต้นสามารถอธิบายได้ดังนี้: CaCO3(s) → CaO (s) + CO2(G) เนื่องจากเปลือกโลกอุดมไปด้วยหินปูนและแคลเซียมคาร์บอเนตและในมหาสมุทรและชายหาดเป็นเปลือกหอยที่อุดมสมบูรณ์ (วัตถุดิบสำหรับการผลิตแคลเซียมออกไซด์) แคลเซียมออกไซด์จึงเป็นน้ำยาที่ค่อนข้างถูก.
ดัชนี
- 1 สูตร
- 2 โครงสร้าง
- 3 คุณสมบัติ
- 3.1 การละลาย
- 4 ใช้
- 4.1 เป็นครก
- 4.2 ในการผลิตแว่นตา
- 4.3 ในการขุด
- 4.4 เป็นตัวกำจัดซิลิเกต
- 5 อนุภาคนาโนของแคลเซียมออกไซด์
- 6 อ้างอิง
สูตร
สูตรทางเคมีของแคลเซียมออกไซด์คือ CaO ซึ่งแคลเซียมเป็นเหมือนกรดอิออน (ตัวรับอิเล็กตรอน) Ca2+, และออกซิเจนเป็นไอออนพื้นฐาน (ผู้บริจาคอิเล็กตรอน) หรือ2--.
ทำไมแคลเซียมจึงมีประจุ +2 เนื่องจากแคลเซียมอยู่ในกลุ่ม 2 ของตารางธาตุ (นาย Becambara) และมีเพียงวาเลนซ์อิเล็กตรอนสองตัวสำหรับการก่อตัวของพันธะซึ่งให้อะตอมออกซิเจน.
โครงสร้าง
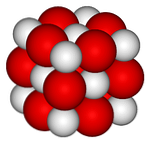
ในภาพด้านบนจะแสดงโครงสร้างผลึก (ประเภทอัญมณี - เกลือ) สำหรับแคลเซียมออกไซด์ ทรงกลมสีแดงมากมายนั้นสอดคล้องกับไอออน Ca2+ และทรงกลมสีขาวต่อไอออน O2-.
ในการจัดเรียงลูกบาศก์คริสตัลแต่ละไอออน Ca2+ ล้อมรอบด้วยไอออนหกตัว O2-, อุดตันในหลุมแปดด้านที่เหลือจากไอออนขนาดใหญ่ระหว่างพวกเขา.
โครงสร้างนี้แสดงออกถึงลักษณะไอออนิกสูงสุดของออกไซด์นี้ถึงแม้ว่าความแตกต่างที่น่าทึ่งของรัศมี (ทรงกลมสีแดงมีขนาดใหญ่กว่าสีขาว) ให้พลังงานพลังงานตาข่ายผลึกอ่อนกว่าเมื่อเทียบกับ MgO.
สรรพคุณ
ในทางกายภาพมันเป็นผลึกสีขาวแข็งไม่มีกลิ่นและมีการเกิดปฏิกิริยาที่แข็งแกร่งซึ่งมีความรับผิดชอบสำหรับจุดหลอมเหลวสูง (2572 ° C) และเดือด (2850 ° C) นอกจากนี้ยังมีน้ำหนักโมเลกุลของ 55,958 g / mol และคุณสมบัติที่น่าสนใจของการเป็น thermoluminescent.
ซึ่งหมายความว่าชิ้นส่วนของแคลเซียมออกไซด์ที่สัมผัสกับเปลวไฟสามารถเปล่งประกายด้วยแสงสีขาวที่เข้มข้นซึ่งเป็นที่รู้จักในชื่อภาษาอังกฤษ ไฟแก็ซ, หรือสเปนแสงแคลเซียม ไอออน Ca2+, เมื่อสัมผัสกับไฟจะทำให้เกิดเปลวไฟสีแดงดังแสดงในภาพต่อไปนี้.

สามารถในการละลาย
CaO เป็นออกไซด์พื้นฐานที่มีความสัมพันธ์ที่ใกล้ชิดกับน้ำในระดับที่มันดูดซับความชื้น (เป็นของแข็งดูดความชื้น) ทำปฏิกิริยาทันทีเพื่อผลิตปูนขาวหรือแคลเซียมไฮดรอกไซด์:
CaO + s2O (l) => Ca (OH)2(S)
ปฏิกิริยานี้คือคายความร้อน (ปล่อยความร้อน) เนื่องจากการก่อตัวของของแข็งที่มีปฏิสัมพันธ์ที่แข็งแกร่งและตาข่ายคริสตัลที่มีเสถียรภาพมากขึ้น อย่างไรก็ตามปฏิกิริยาสามารถย้อนกลับได้ถ้า Ca (OH) ถูกทำให้ร้อน2, เหือดแห้งมันและส่องแสงมะนาว slaked; จากนั้นมะนาว "เกิดใหม่".
วิธีการแก้ปัญหาที่เกิดขึ้นเป็นพื้นฐานมากและถ้ามันอิ่มตัวด้วยแคลเซียมออกไซด์ก็จะถึงค่า pH 12.8.
ในทำนองเดียวกันมันสามารถละลายได้ในกลีเซอรีนและในสารละลายกรดและน้ำตาล เนื่องจากเป็นออกไซด์พื้นฐานจึงมีปฏิกิริยากับกรดออกไซด์ (SiO) ตามธรรมชาติ2, ไป2O3 และศรัทธา2O3, ตัวอย่าง) การละลายในเฟสของเหลว ในทางตรงกันข้ามมันไม่ละลายในแอลกอฮอล์และตัวทำละลายอินทรีย์.
การใช้งาน
CaO มีการใช้ในอุตสาหกรรมมากมายเช่นเดียวกับการสังเคราะห์อะเซทิลีน (CH≡CH) ในการสกัดฟอสเฟตจากน้ำเสียและปฏิกิริยากับซัลเฟอร์ไดออกไซด์จากขยะก๊าซ.
การใช้งานอื่น ๆ ของแคลเซียมออกไซด์อธิบายไว้ด้านล่าง:
เหมือนครก
หากแคลเซียมออกไซด์ผสมกับทราย (SiO)2) และน้ำเค้กด้วยทรายและทำปฏิกิริยาช้าๆกับน้ำเพื่อสร้างมะนาว ในทางกลับกันผู้บังคับกองร้อย2 ของอากาศละลายในน้ำและทำปฏิกิริยากับเกลือออกเป็นแคลเซียมคาร์บอเนต:
Ca (OH)2(s) + CO2(g) => CaCO3(s) + H2O (l)
The CaCO3 มันเป็นสารประกอบที่ทนต่อและแข็งกว่า CaO ทำให้ปูน (ส่วนผสมก่อนหน้า) แข็งและแก้ไขอิฐบล็อกหรือเซรามิกระหว่างพวกเขาหรือพื้นผิวที่ต้องการ.
ในการผลิตแว่นตา
วัตถุดิบที่จำเป็นสำหรับการผลิตแว่นตาคือซิลิคอนออกไซด์ซึ่งผสมกับมะนาว, โซเดียมคาร์บอเนต (นา)2CO3) และสารเติมแต่งอื่น ๆ จากนั้นจะถูกทำให้ร้อน ของแข็งนี้จะถูกทำให้ร้อนและถูกเป่าในรูปใด ๆ.
ในการขุด
มะนาวที่ผ่านการฆ่าเชื้อนั้นมีปริมาณมากกว่าการทำปูนขาวเนื่องจากปฏิกิริยาระหว่างไฮโดรเจนกับพันธะ (O-H-O) คุณสมบัตินี้ใช้เพื่อแยกหินออกจากภายใน.
นี่คือความสำเร็จโดยการกรอกพวกเขาด้วยส่วนผสมที่กะทัดรัดของมะนาวและน้ำซึ่งถูกปิดผนึกเพื่อมุ่งเน้นความร้อนและพลังงานที่กว้างขวางในหิน.
ในฐานะที่เป็นน้ำยาล้างซิลิเกต
CaO ถูกหลอมรวมกับซิลิเกตเพื่อก่อให้เกิดของเหลวรวมกันซึ่งจะถูกสกัดออกมาจากวัตถุดิบของผลิตภัณฑ์บางชนิด.
ตัวอย่างเช่นแร่เหล็กเป็นวัตถุดิบสำหรับการผลิตเหล็กและโลหะ แร่ธาตุเหล่านี้มีซิลิเกตซึ่งเป็นสิ่งเจือปนที่ไม่พึงประสงค์สำหรับกระบวนการและถูกกำจัดโดยวิธีที่เพิ่งอธิบาย.
อนุภาคนาโนของแคลเซียมออกไซด์
แคลเซียมออกไซด์สามารถสังเคราะห์เป็นอนุภาคนาโนซึ่งจะเปลี่ยนความเข้มข้นของแคลเซียมไนเตรต (Ca (NO3)2) และโซเดียมไฮดรอกไซด์ (NaOH) ในสารละลาย.
อนุภาคเหล่านี้เป็นทรงกลมพื้นฐาน (เช่นเดียวกับของแข็งระดับมหภาค) และมีพื้นที่ผิวจำนวนมาก ดังนั้นคุณสมบัติเหล่านี้มีประโยชน์ต่อกระบวนการเร่งปฏิกิริยา อะไร? การสืบสวนกำลังตอบคำถามนั้นอยู่.
อนุภาคนาโนเหล่านี้ถูกนำมาใช้เพื่อสังเคราะห์สารประกอบอินทรีย์ทดแทน - ซึ่งได้มาจากไพริดีน - ในการกำหนดยาใหม่เพื่อดำเนินการเปลี่ยนแปลงทางเคมีเช่นการสังเคราะห์ด้วยแสงสังเคราะห์สำหรับการทำน้ำให้บริสุทธิ์จากโลหะหนักและเป็นพิษและเป็น ตัวแทนตาแมว.
อนุภาคนาโนสามารถสังเคราะห์ได้บนการสนับสนุนทางชีวภาพเช่นใบมะละกอและชาเขียวเพื่อใช้เป็นสารต้านแบคทีเรีย.
การอ้างอิง
- scifun.org (2018). มะนาว: แคลเซียมออกไซด์. สืบค้นเมื่อวันที่ 30 มีนาคม 2018 จาก: scifun.org.
- วิกิพีเดีย (2018) แคลเซียมออกไซด์ สืบค้นเมื่อวันที่ 30 มีนาคม 2018 จาก: en.wikipedia.org
- Ashwini Anantharaman และคณะ (2016) การสังเคราะห์สีเขียวของอนุภาคนาโนแคลเซียมออกไซด์และการประยุกต์ใช้ ภายในวารสารการวิจัยและการประยุกต์ทางวิศวกรรม ISSN: 2248-9622, เล่มที่ 6, ฉบับที่ 10, (ส่วนที่ -1), pp.27-31.
- J. Safaei-Ghomi และคณะ (2013) อนุภาคนาโนแคลเซี่ยมออกไซด์เร่งปฏิกิริยาการสังเคราะห์หลายส่วนประกอบขั้นตอนเดียวของไพริดีนที่ถูกแทนที่อย่างสูงในตัวกลางเอธานอลน้ำวิทยาศาสตร์ Scientia Iranica, ธุรกรรม C: เคมีและวิศวกรรมเคมี.
- PubChem (2018) แคลเซียมออกไซด์ สืบค้นเมื่อวันที่ 30 มีนาคม 2018 จาก: pubchem.ncbi.nlm.nih.gov
- ตัวสั่นและแอตกินส์ (2008) เคมีอนินทรีย์ ใน องค์ประกอบของกลุ่ม 2. (ฉบับที่สี่, หน้า 280) Mc Graw Hill.


