โครงสร้างโบรอนออกไซด์ (B2O3) คุณสมบัติการเรียกชื่อและการใช้งาน
โบรอนออกไซด์ หรือบอริกแอนไฮไดรด์เป็นสารประกอบอนินทรีย์ซึ่งสูตรทางเคมีคือ B2O3. เนื่องจากธาตุโบรอนและออกซิเจนของบล็อก p ของตารางธาตุและหัวของกลุ่มที่เกี่ยวข้องยิ่งกว่านั้นความแตกต่างของอิเล็กโตรเนกาติวีตี้ระหว่างพวกเขาจึงไม่สูงมาก ดังนั้นจึงเป็นที่คาดหวังว่า B2O3 เป็นโควาเลนต์ในธรรมชาติ.
The B2O3 มันถูกเตรียมโดยการละลายบอแรกซ์ในกรดซัลฟิวริกเข้มข้นภายในเตาหลอมและที่อุณหภูมิ 750 ° C; กรดบอริกที่สูญเสียความร้อน, B (OH)3, ที่อุณหภูมิประมาณ 300 ° C; หรือมันยังสามารถเกิดเป็นผลิตภัณฑ์ของปฏิกิริยา diborane (B2H6) กับออกซิเจน.

โบรอนออกไซด์สามารถมีลักษณะกึ่งโปร่งใสหรือเป็นผลึกกึ่งโปร่งใส หลังสามารถรับได้โดยการบดในรูปแบบผง (ภาพบน).
แม้ว่ามันอาจจะไม่ได้เห็นตั้งแต่แรกเห็น แต่ก็ถือว่าเป็น B2O3 เป็นหนึ่งในอนินทรีย์ออกไซด์ที่ซับซ้อนที่สุด; ไม่เพียง แต่จากมุมมองเชิงโครงสร้างเท่านั้น แต่ยังเนื่องมาจากคุณสมบัติตัวแปรที่แว่นตาและเซรามิกได้รับซึ่งพวกเขาจะถูกเพิ่มเข้าไปในเมทริกซ์ของพวกเขา.
ดัชนี
- 1 โครงสร้างของโบรอนออกไซด์
- 1.1 หน่วย BO3
- 1.2 โครงสร้างผลึก
- 1.3 โครงสร้างคล้ายแก้ว
- 2 คุณสมบัติ
- 2.1 ลักษณะทางกายภาพ
- 2.2 มวลโมเลกุล
- 2.3 Taste
- 2.4 ความหนาแน่น
- 2.5 จุดหลอมเหลว
- 2.6 จุดเดือด
- 2.7 เสถียรภาพ
- 3 ศัพท์
- 4 ใช้
- 4.1 การสังเคราะห์โบรอนไตรฮาไลด์
- 4.2 ยาฆ่าแมลง
- 4.3 ตัวทำละลายของโลหะออกไซด์: การก่อตัวของแก้วเซรามิกและโลหะผสมโบรอน
- 4.4 Binder
- 5 อ้างอิง
โครงสร้างของโบรอนออกไซด์
หน่วย BO3
The B2O3 เป็นของแข็งโควาเลนต์ดังนั้นในทางทฤษฎีแล้วไม่มีไอออน B ในโครงสร้าง3+ หรือ O2-, แต่ลิงก์ B-O โบรอนตามทฤษฎีพันธะเวเลนซ์ (VTE) สามารถสร้างพันธะโควาเลนต์ได้สามแบบเท่านั้น ในกรณีนี้สามลิงก์ B-O จากผลของสิ่งนี้เรขาคณิตที่คาดหวังจะต้องเป็นตรีโกณมิติ BO3.
โมเลกุลของ BO3 มันขาดอิเล็กตรอนโดยเฉพาะอย่างยิ่งอะตอมออกซิเจน อย่างไรก็ตามหลายคนสามารถโต้ตอบซึ่งกันและกันเพื่อหาข้อบกพร่องดังกล่าว ดังนั้นสามเหลี่ยม BO3 พวกเขาเข้าร่วมด้วยการแบ่งปันสะพานออกซิเจนและพวกมันถูกแจกจ่ายในอวกาศในฐานะเครือข่ายแถวรูปสามเหลี่ยมที่มีเครื่องบินของพวกเขามุ่งเน้นไปในวิธีที่ต่าง.
โครงสร้างผลึก
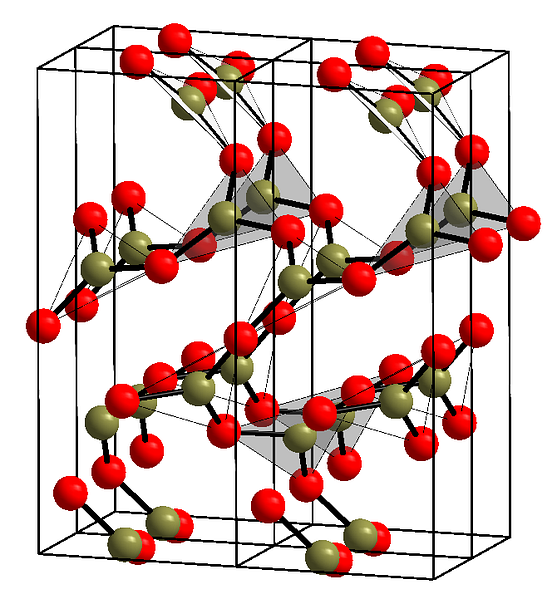
ภาพด้านบนแสดงตัวอย่างของแถวที่กล่าวด้วยหน่วยสามเหลี่ยม BO3. หากคุณมองอย่างระมัดระวังไม่ใช่ทุกหน้าของเครื่องบินที่ชี้ไปที่ผู้อ่าน แต่ไปที่อีกด้านหนึ่ง การวางแนวของใบหน้าเหล่านี้อาจเป็นสาเหตุของวิธีการกำหนด B2O3 ที่อุณหภูมิและความดัน.
เมื่อเครือข่ายเหล่านี้มีรูปแบบโครงสร้างระยะยาวมันเป็นผลึกของแข็งซึ่งสามารถสร้างจากเซลล์หน่วยของมัน นี่คือที่ที่ถูกกล่าวข2O3 มันมีสองรูปแบบผลึก: αและβ.
α-B2O3 เกิดขึ้นที่ความดันบรรยากาศ (1 atm) และถูกกล่าวว่ามีความไม่แน่นอนทางจลนศาสตร์ อันที่จริงนี่เป็นหนึ่งในเหตุผลที่โบรอนออกไซด์อาจเป็นสารประกอบของการตกผลึกยาก.
polymorph อื่น ๆ , β-B2O3, มันจะได้รับแรงกดดันสูงในช่วงเกรดเฉลี่ย; ดังนั้นความหนาแน่นของมันจะต้องมากกว่าα-B2O3.
โครงสร้างน้ำเลี้ยง
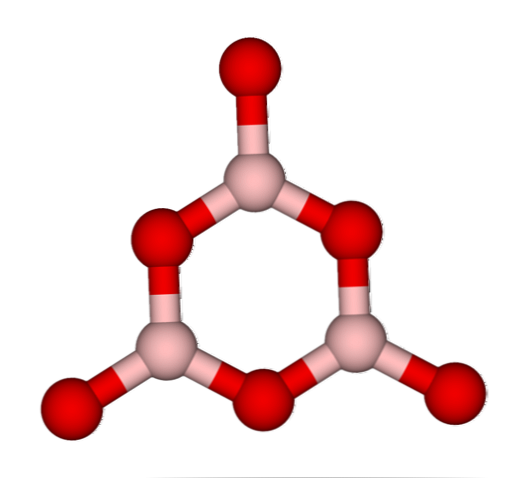
เครือข่าย BO3 ตามธรรมชาติพวกเขามีแนวโน้มที่จะนำโครงสร้างอสัณฐาน; สิ่งเหล่านี้คือสิ่งที่ขาดรูปแบบที่อธิบายถึงโมเลกุลหรือไอออนในของแข็ง โดยการสังเคราะห์ B2O3 รูปแบบเด่นของมันคืออสัณฐานและไม่เป็นผลึก ในคำที่ถูกต้อง: มันเป็นน้ำเลี้ยงแข็งกว่าผลึก.
ได้มีการกล่าวแล้วว่า B2O3 มันเป็นน้ำเลี้ยงหรืออสัณฐานเมื่อเครือข่าย BO ของมัน3 พวกเขายุ่ง ไม่เพียงแค่นี้ แต่พวกเขายังเปลี่ยนวิธีที่พวกเขามารวมกัน แทนที่จะจัดเรียงในรูปทรงเรขาคณิตแบบตรีโกณมิติพวกมันถูกเชื่อมโยงกันเพื่อสร้างสิ่งที่นักวิจัยเรียกว่าโบโรอกโซลวงแหวน (ภาพบนสุด).
สังเกตเห็นความแตกต่างที่ชัดเจนระหว่างหน่วยสามเหลี่ยมและหกเหลี่ยม รูปสามเหลี่ยมลักษณะ B2O3 ผลึกและหกเหลี่ยมถึง B2O3 คล้ายแก้ว อีกวิธีในการอ้างถึงเฟสอสัณฐานนี้คือแก้วโบรอนหรือโดยสูตร: g-B2O3 (ตัว 'g' มาจากคำว่า glassy เป็นภาษาอังกฤษ).
ดังนั้นเครือข่าย G-B2O3 พวกมันประกอบไปด้วยวงแหวน boroxol ไม่ใช่หน่วยของ BO3. อย่างไรก็ตามการ g-B2O3 สามารถตกผลึกเป็นα-B2O3, ซึ่งจะหมายถึงการเชื่อมต่อของแหวนกับรูปสามเหลี่ยมและยังกำหนดระดับของการตกผลึกที่ประสบความสำเร็จ.
สรรพคุณ
ลักษณะทางกายภาพ
มันเป็นของแข็งไม่มีสีและเหลือบ ในรูปแบบผลึกมันเป็นสีขาว.
มวลโมเลกุล
69.6182 g / mol.
รสชาติ
ขมเล็กน้อย
ความหนาแน่น
-คริสตัลลีน: 2.46 g / mL.
-น้ำเลี้ยง: 1.80g / mL.
จุดหลอมเหลว
มันไม่ได้มีจุดหลอมเหลวที่กำหนดอย่างเต็มที่เพราะมันขึ้นอยู่กับว่ามันเป็นผลึกหรือน้ำเลี้ยง รูปแบบผลึกล้วนละลายที่ 450 ° C; อย่างไรก็ตามรูปแบบแก้วละลายในช่วงอุณหภูมิตั้งแต่ 300 ถึง 700 toC.
จุดเดือด
อีกครั้งค่าที่รายงานไม่ตรงกับค่านี้ เห็นได้ชัดว่าโบรอนออกไซด์เหลว (ละลายจากผลึกหรือแก้ว) เดือดที่ 2403 องศาเซลเซียส.
ความมั่นคง
มันจะต้องเก็บไว้ในที่แห้งเพราะมันดูดซับความชื้นเพื่อเปลี่ยนเป็นกรดบอริก, B (OH)3.
ศัพท์เฉพาะ
โบรอนออกไซด์สามารถตั้งชื่อได้ด้วยวิธีอื่นเช่น:
-Diboro trioxide (ระบบการตั้งชื่อ).
-โบรอนออกไซด์ (III) (ระบบเรียกชื่อหุ้น).
-Boric ออกไซด์ (ระบบการตั้งชื่อแบบดั้งเดิม).
การใช้งาน
การใช้ประโยชน์ของโบรอนออกไซด์บางส่วนคือ:
การสังเคราะห์โบรอนไตรฮาไลด์
จาก B2O3 สามารถสังเคราะห์โบรอนไตรฮาไลด์ BX ได้3 (X = F, Cl และ Br) สารประกอบเหล่านี้คือกรดลิวอิสและมีความเป็นไปได้ที่จะนำโบรอนอะตอมมาใช้กับโมเลกุลบางชนิดเพื่อให้ได้อนุพันธ์อื่นที่มีคุณสมบัติใหม่.
ยาฆ่าแมลง
ส่วนผสมที่เป็นของแข็งกับกรดบอริก2O3-B (OH)3, แสดงถึงสูตรที่ใช้เป็นยาฆ่าแมลงในประเทศ.
ตัวทำละลายของโลหะออกไซด์: การก่อตัวของแก้วเซรามิกและโลหะผสมโบรอน
โบรอนออกไซด์เหลวสามารถละลายออกไซด์ของโลหะได้ จากการผสมที่เกิดขึ้นนี้เมื่อเย็นลงจะได้ของแข็งโดยโบรอนและโลหะ.
ขึ้นอยู่กับปริมาณของ B2O3 ใช้เช่นเดียวกับเทคนิคและประเภทของโลหะออกไซด์คุณสามารถได้รับความหลากหลายของแก้ว (borosilicates) เซรามิก (ไนไตรด์และโบรอนคาร์ไบด์) และโลหะผสม (ถ้าใช้เฉพาะโลหะ).
โดยทั่วไปแล้วแก้วหรือเซรามิกจะมีความแข็งแรงและความแข็งแรงมากขึ้นรวมถึงความทนทานที่มากขึ้น ในกรณีของแว่นตาพวกเขาถูกนำมาใช้สำหรับเลนส์และกล้องโทรทรรศน์และอุปกรณ์อิเล็กทรอนิกส์.
เครื่องผูก
ในการก่อสร้างเตาหลอมเหล็กจะใช้อิฐทนไฟพร้อมฐานแมกนีเซียม ในพวกเขาโบรอนออกไซด์จะถูกใช้เป็นสารยึดเกาะช่วยให้พวกเขาผูกพันอย่างแน่นหนา.
การอ้างอิง
- ตัวสั่นและแอตกินส์ (2008) เคมีอนินทรีย์ (ฉบับที่สี่) Mc Graw Hill.
- วิกิพีเดีย (2019) โบรอนไตรออกไซด์ สืบค้นจาก: en.wikipedia.org
- PubChem (2019) บอริกออกไซด์ สืบค้นจาก: pubchem.ncbi.nlm.nih.gov
- Rio Tinto (2019) บอริกซ์ออกไซด์ Borax 20 ทีม ดึงจาก: borax.com
- A. Mukhanov, O. O. Kurakevich และ V. L. Solozhenko ( N.d. ) เรื่องความแข็งของโบรอน (III) ออกไซด์ LPMTMCNRS, Université Paris Nord, Villetaneuse, ฝรั่งเศส.
- Hansen T. (2015) B2O3 บอริกออกไซด์. ดึงมาจาก: digitalfire.com


