สูตรโซเดียมซัลเฟต, คุณสมบัติ, โครงสร้าง, การใช้งาน
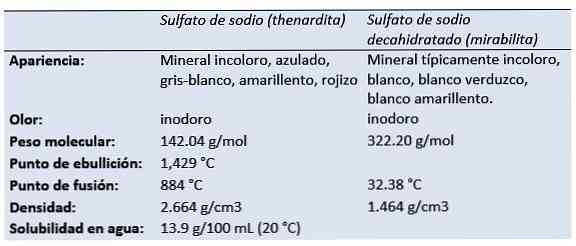
โซเดียมซัลเฟต (เกลือ disodium ของกรดซัลฟูริก, disodium tetraoxidosulfate, ซัลเฟตของโซดา, เกลือของ Glauber, thenardite, mirabilite) เป็นสารประกอบอนินทรีย์ที่มีสูตร Na2SW4 และไฮเดรตที่เกี่ยวข้อง ทุกรูปแบบเป็นของแข็งสีขาวที่ละลายได้ในน้ำ.
ถือเป็นหนึ่งในผลิตภัณฑ์เคมีหลักออกวางตลาด การผลิตทั่วโลกของมัน (เกือบเฉพาะในรูปแบบของ decahydrate) มีจำนวนประมาณ 6 ล้านตันต่อปี.

Thenardite เป็นแร่โซเดียมซัลเฟตปราศจากที่ผลิตในสภาพแวดล้อมที่แห้งแล้งระเหยในถ้ำแห้งในการทำเหมืองแบบเก่าในฐานะที่มีการออกดอกและเป็นคราบรอบ fumaroles.
มันถูกอธิบายครั้งแรกใน 1825 ในซาลินาส Espartinas (Ciempozuelos, มาดริด, สเปน) และเป็นชื่อ thenardita เพื่อเป็นเกียรติแก่นักเคมีชาวฝรั่งเศส Louis Jacques Thénard (1777-1826).

นักเคมีชาวดัตช์ / เยอรมันและเภสัชกรโยฮันน์ Rudolf Glauber (1604-1670) ค้นพบใน 1625 ในน้ำของฤดูใบไม้ผลิออสเตรีย, โซเดียมซัลเฟต decahydrate (ภายหลังเรียกว่าเกลือของ Glauber) เขาเรียกมันว่าเกลือ mirabilis (เกลือมหัศจรรย์) เนื่องจากคุณสมบัติทางยา.
ระหว่างปี 1650 ถึง 1660 Glauber เริ่มผลิตโซเดียมซัลเฟตจากเกลือทั่วไป (NaCl) และกรดซัลฟิวริกเข้มข้น กระบวนการนี้ถือเป็นจุดเริ่มต้นของอุตสาหกรรมเคมี.
ผลึกของมันถูกใช้เป็นยาระบายจนถึงศตวรรษที่ 20.
ในศตวรรษที่สิบแปดปฏิกิริยาของเกลือของ Glauber กับโปแตช (โพแทสเซียมคาร์บอเนต) เริ่มนำมาใช้ในอุตสาหกรรมการผลิตโซดาแอช (โซเดียมคาร์บอเนต).

ปัจจุบันใช้เป็นหลักในการผลิตผงซักฟอกและในกระบวนการคราฟท์สำหรับการผลิตเยื่อกระดาษ (วิธีการที่โดดเด่นในการผลิตกระดาษ).
แหล่งแร่โซเดียมซัลเฟตพบได้ในสหรัฐอเมริกาแคนาดาสเปนอิตาลีตุรกีโรมาเนียเม็กซิโกบอตสวานาจีนอียิปต์มองโกเลียและแอฟริกาใต้.
ผู้ผลิตหลักคือจีน (จังหวัดของมณฑลเจียงซูและมณฑลเสฉวน) ตามด้วยสเปนซึ่งเป็นแหล่งแร่ glauberite ที่ใหญ่ที่สุดในโลกตั้งอยู่ (ใน Cerezo de RíoTirón, Burgos).
การผลิตโซเดียมซัลเฟตของโลกโดยรวมอยู่ที่ประมาณ 8 ล้านตันและเป็นผลพลอยได้จากกระบวนการอุตสาหกรรมอื่น ๆ ระหว่าง 2 และ 4 ตัน.
ในประเทศสเปนตามข้อมูลที่ตีพิมพ์ใน National Inventory ของ Sodium Sulphate Resources และข้อมูลที่อัพเดทอื่น ๆ หุ้นที่ประเมินโดยแร่โซเดียมซัลเฟตในคำสั่งของ 730 Mt จัดเป็นหมวดหมู่ "สำรอง" และอีก 300 รายการเพิ่มเติมเป็น "ทรัพยากรอื่น ๆ ".
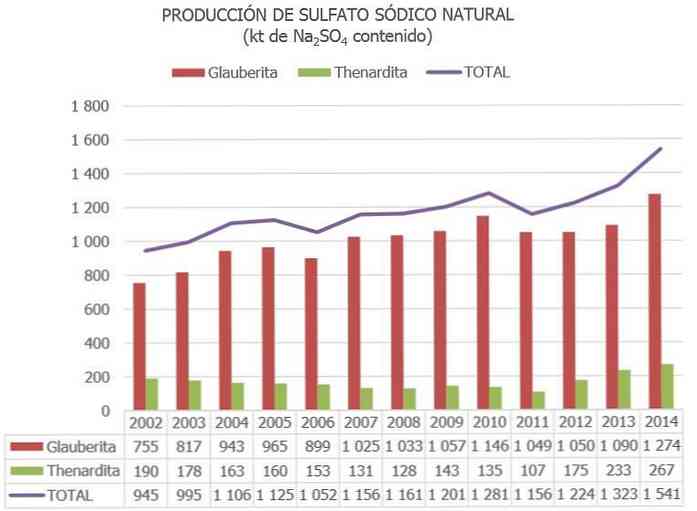
ในสหภาพยุโรปปัจจุบันสเปนเป็นประเทศเดียวที่มีแร่โซเดียมซัลเฟต (ส่วนใหญ่เป็น Thenardite, Glauberite และ Mirabilite).
ในปัจจุบันมีความต้องการโซเดียมซัลเฟตลดลงในภาคอุตสาหกรรมสิ่งทอ.
ในช่วงไม่กี่ปีที่ผ่านมาภาคอื่น ๆ เช่นผงซักฟอกมีการเติบโตในบางภูมิภาคเนื่องจากราคาวัตถุดิบต่ำ.
ตลาดที่กำลังขยายตัวหลักสำหรับผงซักฟอกโซเดียมซัลเฟตพบได้ในเอเชียอเมริกากลางและอเมริกาใต้.
สูตร

โครงสร้าง 2D
โครงสร้าง 3 มิติ
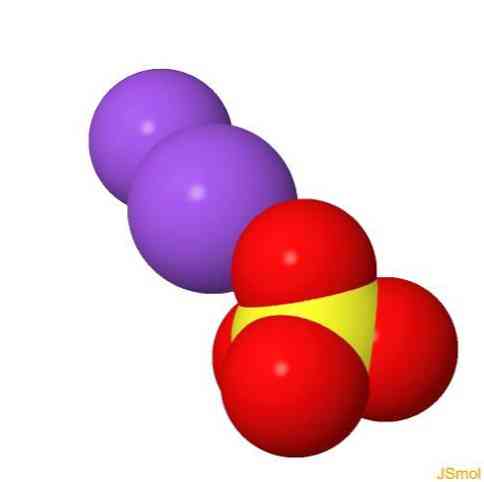
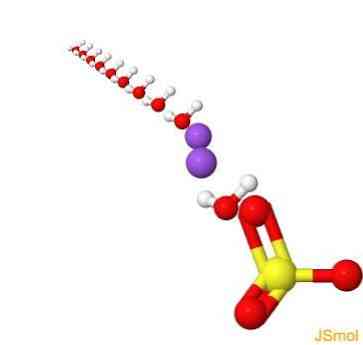
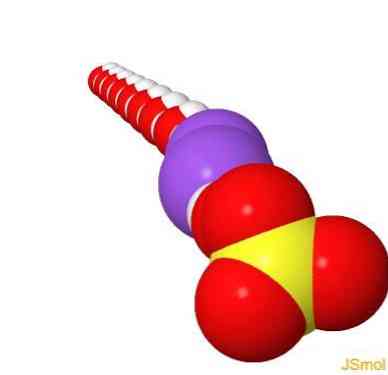
คุณสมบัติ
คุณสมบัติทางกายภาพและทางเคมี
โซเดียมซัลเฟตเป็นของกลุ่มปฏิกิริยาของโซเดียมและยังเป็นของกลุ่มของซัลเฟต, ไฮโดรเจนซัลเฟตและ disulphites.
การลุกไหม้ได้
มันเป็นสารที่ไม่ติดไฟ ไม่มีความเสี่ยงจากการระเบิดของผง.
การเกิดปฏิกิริยา
โซเดียมซัลเฟตละลายได้ในน้ำและอุ้มน้ำ มีความเสถียรสูงไม่ทำปฏิกิริยาต่อตัวออกซิไดซ์หรือตัวรีดิวซ์ส่วนใหญ่ที่อุณหภูมิปกติ ที่อุณหภูมิสูงสามารถเปลี่ยนเป็นโซเดียมซัลไฟด์ได้โดยการลดความร้อนลง.
สารเคมีที่ไม่ทำปฏิกิริยาจะถูกพิจารณาว่าไม่ทำปฏิกิริยาภายใต้สภาพแวดล้อมทั่วไป (แม้ว่าพวกเขาจะทำปฏิกิริยาในสถานการณ์ที่ค่อนข้างรุนแรงหรือในการเร่งปฏิกิริยา) พวกเขาทนต่อการเกิดออกซิเดชันและลด (ยกเว้นในสภาวะที่รุนแรง).
ปฏิกิริยาทางเคมีที่เป็นอันตราย
เมื่ออลูมิเนียมหลอมรวมกับโซเดียมหรือโพแทสเซียมซัลเฟตจะเกิดการระเบิดอย่างรุนแรง.
ความเป็นพิษ
สารเคมีที่ไม่เกิดปฏิกิริยาถือเป็นสารพิษ (แม้ว่าสารที่เป็นก๊าซจากกลุ่มนี้สามารถทำหน้าที่เป็น asphyxiants).
แม้ว่าโซเดียมซัลเฟตโดยทั่วไปถือว่าปลอดสารพิษ แต่ก็ต้องได้รับการดูแลอย่างระมัดระวัง ผงอาจทำให้เกิดโรคหอบหืดหรือระคายเคืองตาชั่วคราว ความเสี่ยงนี้สามารถหลีกเลี่ยงได้โดยการสวมอุปกรณ์ป้องกันดวงตาและหน้ากากกระดาษ.
การใช้งาน
การใช้งานหลักในการผลิต:
- ผงซักฟอก.
- เยื่อกระดาษ.
- สิ่งทอ.
- แก้ว.
- การสังเคราะห์เอนไซม์ (การทำไวน์).
- อาหารของมนุษย์และสัตว์.
- ผลิตภัณฑ์ยา.
- เคมีพื้นฐานโดยทั่วไป.
- กระบวนการเหล็ก.
- ผงซักฟอก
โซเดียมซัลเฟตเป็นวัสดุราคาถูกมาก การใช้งานที่ใหญ่ที่สุดคือฟิลเลอร์ในผงซักฟอกที่ใช้ในครัวเรือน 50% ของการผลิตทั่วโลก ผงซักฟอกแบบคอมแพคหรือของเหลวใหม่ไม่รวมโซเดียมซัลเฟตดังนั้นการใช้งานจึงลดลง.
การใช้โซเดียมซัลเฟตอีกชนิดหนึ่งที่มีความสำคัญลดลงโดยเฉพาะในสหรัฐอเมริกา และแคนาดาอยู่ในกระบวนการคราฟท์สำหรับการผลิตเยื่อไม้ ความก้าวหน้าในประสิทธิภาพเชิงความร้อนของกระบวนการลดความต้องการโซเดียมซัลเฟตอย่างมาก.
อุตสาหกรรมแก้วเป็นอีกหนึ่งแอปพลิเคชันที่สำคัญสำหรับโซเดียมซัลเฟต มันเป็นแอปพลิเคชั่นที่ใหญ่เป็นอันดับสองในยุโรป โซเดียมซัลเฟตถูกใช้เพื่อช่วยกำจัดฟองอากาศขนาดเล็กออกจากแก้วหลอมเหลว.
ในประเทศญี่ปุ่นการใช้โซเดียมซัลเฟตที่ใหญ่ที่สุดคือการผลิตสิ่งทอ โซเดียมซัลเฟตช่วยให้สีย้อมซึมผ่านเส้นใยอย่างสม่ำเสมอและไม่กัดกร่อนภาชนะสแตนเลสที่ใช้ในการย้อมสี (ต่างจากโซเดียมคลอไรด์ซึ่งเป็นวิธีทางเลือก).
โซเดียมซัลเฟตเหมาะอย่างยิ่งสำหรับการจัดเก็บความร้อนจากแสงอาทิตย์ที่มีคุณภาพต่ำ (สำหรับการปล่อยในภายหลังในการใช้งานเครื่องทำความร้อน) เนื่องจากความสามารถในการเก็บความร้อนสูงในระหว่างการเปลี่ยนสถานะจากของแข็งเป็นของเหลวซึ่งให้ที่ 32 ° C.
สำหรับการใช้งานในการทำความเย็นส่วนผสมที่มีเกลือทั่วไปโซเดียมคลอไรด์ (NaCl) ช่วยลดจุดหลอมเหลวถึง 18 ° C.
ในห้องปฏิบัติการโซเดียมซัลเฟตปราศจากน้ำถูกใช้อย่างกว้างขวางในฐานะตัวแทนการอบแห้งเฉื่อยเพื่อกำจัดร่องรอยของน้ำจากสารละลายอินทรีย์ การกระทำของมันช้ากว่าแมกนีเซียมซัลเฟต แต่สามารถใช้ได้กับวัสดุหลายชนิดเนื่องจากมันค่อนข้างเฉื่อยทางเคมี.
Sodium sulfate decahydrate (เกลือของ Glauber) เคยใช้เป็นยาระบาย มีประสิทธิภาพในการกำจัดยาบางชนิดเช่น acetaminophen (acetaminophen) ออกจากร่างกายหลังจากใช้ยาเกินขนาด.
แอปพลิเคชันอื่น ๆ สำหรับโซเดียมซัลเฟตประกอบด้วยการใช้เป็นสารเติมแต่งในการผลิตสารให้ความสดชื่นของพรมปูพื้น, เป็นสารเติมแต่งในอาหารสัตว์และในการผลิตแป้ง.
ผลทางคลินิก
สำหรับการใช้งานด้านการรักษานั้นโซเดียมซัลเฟตนั้นอยู่ในหมวดหมู่ของยาระบายน้ำเกลือและยาระบายที่ใช้ในการรักษาอาการท้องผูก.
Saline cathartics เป็นเกลือที่กักเก็บของเหลวในลำไส้โดยการกระทำแบบออสโมติกของเกลือที่ไม่ดูดซับทำให้เพิ่ม peristalsis ทางอ้อม.
คาร์ทธารีนน้ำเกลือจะถูกดูดซึมได้ไม่ดีตามระบบทางเดินอาหารดังนั้นความเป็นพิษต่อระบบจึงไม่น่าเป็นไปได้เว้นแต่จะได้รับสารปริมาณมาก อย่างไรก็ตามการเปิดรับแสงขนาดใหญ่อาจทำให้เกิดการสูญเสียน้ำและการเปลี่ยนแปลงอิเล็กโทรไลต์รองกับผลออสโมติกของสารประกอบ.
การละเมิดยาระบายเรื้อรังสามารถเกิดขึ้นได้ในผู้ป่วยที่มีความผิดปกติของการรับประทานอาหาร, โรค Munchausen หรือความผิดปกติของข้อเท็จจริง โดยทั่วไปแล้วผู้ป่วยจะมีอาการคลื่นไส้อาเจียนและท้องร่วงซึ่งสัมพันธ์กับการเป็นตะคริวในช่องท้อง ผลกระทบที่รุนแรงอาจรวมถึงภาวะขาดน้ำความดันเลือดต่ำภาวะน้ำตาลในเลือดสูงและความผิดปกติของอิเล็กโทรไลต์.
ความปลอดภัยและความเสี่ยง
ข้อความแสดงความเป็นอันตรายของระบบที่กลมกลืนกันทั่วโลกสำหรับการจำแนกและการติดฉลากสารเคมี (SGA).
ระบบความกลมกลืนทั่วโลกสำหรับการจำแนกและการติดฉลากของสารเคมี (SGA) เป็นระบบที่ได้รับการยอมรับในระดับสากลสร้างขึ้นโดยสหประชาชาติที่ออกแบบมาเพื่อแทนที่มาตรฐานการจำแนกประเภทและการติดฉลากที่ใช้ในประเทศต่างๆผ่านการใช้เกณฑ์สากลที่สอดคล้องกัน ประเทศปี 2558).
ประเภทความเป็นอันตราย (และบทที่เกี่ยวข้องของพวกเขาของ GHS) การจำแนกประเภทและมาตรฐานการติดฉลากและคำแนะนำสำหรับโซเดียมซัลเฟตมีดังต่อไปนี้ (European Chemicals Agency, 2017, องค์การสหประชาชาติ, 2015, PubChem, 2017):
ระดับอันตรายของ GHS
H315: ระคายเคืองต่อผิวหนัง [คำเตือนการกัดกร่อน / การระคายเคืองของผิวหนัง - ประเภทที่ 2].
H317: อาจทำให้เกิดปฏิกิริยาภูมิแพ้ผิวหนัง [คำเตือนการแพ้, ผิวหนัง - ประเภทที่ 1].
H319: ระคายเคืองต่อดวงตาอย่างรุนแรง [คำเตือนความเสียหายของดวงตาอย่างรุนแรง / การระคายเคืองตา - ประเภท 2A].
H412: เป็นอันตรายต่อสิ่งมีชีวิตในน้ำและมีผลกระทบระยะยาว [เป็นอันตรายต่อสิ่งแวดล้อมทางน้ำ, อันตรายในระยะยาว - ประเภทที่ 3].
(PubChem, 2017)
รหัสของสภาที่รอบคอบ
P261, P264, P272, P273, P280, P302 + P352, P305 + P351 + P338, P321, P332 + P313, P333 + P313, P337 + P313, P363, และ P501.
การอ้างอิง
- ChemIDplus (2017) โครงสร้าง 3 มิติของ 7757-82-6 - ปราศจากโซเดียมซัลเฟต [ภาพ] สืบค้นจาก: chem.nlm.nih.gov.
- ChemIDplus (2017) โครงสร้าง 3 มิติของ 7727-73-3 - โซเดียมซัลเฟต [USP] [ภาพ] สืบค้นจาก: chem.nlm.nih.gov.
- Dyet, D. (2007) Thenardite Sodium sulfate ใกล้ Sodaville Mineral County Nevada [ภาพ] สืบค้นจาก: en.wikipedia.org.
- สำนักงานเคมีภัณฑ์แห่งยุโรป (ECHA), (2017) บทสรุปของการจำแนกประเภทและการติดฉลาก การจัดประเภทที่สอดคล้องกัน - ภาคผนวก VI ของกฎข้อบังคับ (EC) หมายเลข 1272/2008 (ระเบียบ CLP) โซเดียมซัลเฟต.
- Grumetisho (2012) Mirabilita [ภาพ] สืบค้นจาก: es.wikipedia.org.
- ธนาคารข้อมูลสารอันตราย (HSDB) TOXNET (2017) โซเดียมซัลเฟต Bethesda, MD, EU: หอสมุดแห่งชาติการแพทย์ ดึงมาจาก: toxnet.nlm.nih.gov.
- สถาบันธรณีวิทยาและเหมืองแร่ของสเปน (IGME) (2016) GLAUBERITA-THENARDITA (NATURAL SODIUM SULPHATE) 2014. การขุดพาโนรามา ดึงจาก: igme.es.
- สถาบันแห่งชาติเพื่อความปลอดภัยในการทำงาน (INSHT) (2010) สารเคมีความปลอดภัยระหว่างประเทศ โซเดียมซัลเฟต กระทรวงการจ้างงานและความมั่นคง กรุงมาดริด มันเป็น ดึงจาก: insht.es.
- Langbein Rise (2008) เยื่อกระดาษคราฟท์อย่างต่อเนื่อง [ภาพ] ดึงจาก: wikimedia.org.
- สหประชาชาติ (2558) ระบบที่กลมกลืนกันทั่วโลกสำหรับการจำแนกประเภทและการติดฉลากของผลิตภัณฑ์เคมี (SGA) ฉบับที่หกฉบับปรับปรุง New York, United States: สิ่งพิมพ์ของสหประชาชาติ ดึงมาจาก: unece.org.
- ศูนย์ข้อมูลเทคโนโลยีชีวภาพแห่งชาติ. PubChem ฐานข้อมูล Compound (2016) โซเดียมซัลเฟต - โครงสร้าง PubChem [ภาพ] Bethesda, MD, EU: หอสมุดแห่งชาติยา สืบค้นจาก: pubchem.ncbi.nlm.nih.gov.
- ศูนย์ข้อมูลเทคโนโลยีชีวภาพแห่งชาติ. PubChem ฐานข้อมูล Compound (2016) โซเดียมซัลเฟต - โครงสร้าง PubChem [ภาพ] Bethesda, MD, EU: หอสมุดแห่งชาติยา.
- ศูนย์ข้อมูลเทคโนโลยีชีวภาพแห่งชาติ. PubChem ฐานข้อมูลแบบผสม (2017) โซเดียมซัลเฟตแยกส่วน Bethesda, MD, EU: หอสมุดแห่งชาติการแพทย์ สืบค้นจาก: pubchem.ncbi.nlm.nih.gov.
- ศูนย์ข้อมูลเทคโนโลยีชีวภาพแห่งชาติ. PubChem ฐานข้อมูลแบบผสม (2017) โซเดียมซัลเฟต Bethesda, MD, EU: หอสมุดแห่งชาติการแพทย์ สืบค้นจาก: pubchem.ncbi.nlm.nih.gov.
- Walkerma (2005) Sodium sulfate [ภาพ] สืบค้นจาก: wikimedia.org.
- Wikipedia (2017) กระบวนการคราฟท์ สืบค้นจาก: wikipedia.org.
- Wikipedia (2017) Mirabilita สืบค้นจาก: wikipedia.org.
- Wikipedia (2017) Mirabilite สืบค้นจาก: wikipedia.org.
- Wikipedia (2017) โซเดียมซัลเฟต สืบค้นจาก: wikipedia.org.
- Wikipedia (2017) Solfato di sodium decaidrate สืบค้นจาก: https://it.wikipedia.org.
- Wikipedia (2017) โซเดียมซัลเฟต สืบค้นจาก: wikipedia.org.
- Wikipedia (2017) Thenardita สืบค้นจาก: wikipedia.org.
- Wikipedia (2017) Thenardite สืบค้นจาก: .wikipedia.org.


