ลักษณะสมการและตัวอย่างของปฏิกิริยาดูดความร้อน
ปฏิกิริยาดูดความร้อน คือสิ่งที่ต้องเกิดขึ้นเพื่อดูดซับพลังงานในรูปของความร้อนหรือรังสีจากสภาพแวดล้อม โดยทั่วไปแม้ว่าจะไม่เสมอไป แต่ก็สามารถรับรู้ได้จากอุณหภูมิที่ลดลงในสภาพแวดล้อมของพวกเขา หรือในทางกลับกันพวกเขาต้องการแหล่งความร้อนเช่นเดียวกับที่ได้รับจากเปลวไฟที่ลุกไหม้.
การดูดซับพลังงานหรือความร้อนเป็นสิ่งที่ปฏิกิริยาดูดความร้อนทั้งหมดมีเหมือนกัน ธรรมชาติของสิ่งเดียวกันรวมถึงการเปลี่ยนแปลงที่เกี่ยวข้องมีความหลากหลายมาก พวกเขาควรดูดซับความร้อนเท่าไร คำตอบนั้นขึ้นอยู่กับอุณหพลศาสตร์: อุณหภูมิที่ปฏิกิริยาเกิดขึ้นเอง.

ยกตัวอย่างเช่นปฏิกิริยาดูดความร้อนที่เป็นสัญลักษณ์มากที่สุดอย่างหนึ่งคือการเปลี่ยนสถานะจากน้ำแข็งเป็นน้ำของเหลว น้ำแข็งต้องการดูดซับความร้อนจนกว่าอุณหภูมิจะอยู่ที่ประมาณ0ºC; ที่อุณหภูมินั้นการหลอมเหลวจะเกิดขึ้นเองและน้ำแข็งจะดูดซับจนกระทั่งละลายได้อย่างสมบูรณ์.
ในพื้นที่ร้อนเช่นบนชายฝั่งของชายหาดอุณหภูมิจะสูงขึ้นและน้ำแข็งดูดซับความร้อนได้เร็วขึ้น นั่นคือมันละลายที่ความเร็วสูงกว่า การละลายของธารน้ำแข็งเป็นตัวอย่างของปฏิกิริยาความร้อนที่ไม่ต้องการ.
ทำไมมันเกิดขึ้นด้วยวิธีนี้ เหตุใดน้ำแข็งจึงไม่สามารถแสดงเป็นของแข็งร้อนได้? คำตอบนั้นอยู่ในพลังงานจลน์เฉลี่ยของโมเลกุลน้ำในทั้งสองรัฐและวิธีที่พวกมันมีปฏิสัมพันธ์ซึ่งกันและกันผ่านพันธะไฮโดรเจน.
ในน้ำของเหลวโมเลกุลของมันจะมีอิสระในการเคลื่อนที่มากกว่าในน้ำแข็งซึ่งมันจะสั่นสะเทือนอยู่กับคริสตัล ในการเคลื่อนย้ายโมเลกุลจะต้องดูดซับพลังงานในลักษณะที่การสั่นสะเทือนของมันจะทำลายสะพานไฮโดรเจนที่มีทิศทางในน้ำแข็ง.
ด้วยเหตุนี้น้ำแข็งจึงดูดซับความร้อนละลาย เพื่อให้มี "น้ำแข็งร้อน" สะพานไฮโดรเจนจะต้องมีความแข็งแรงผิดปกติในการละลายที่อุณหภูมิสูงกว่า 0 ° C.
ดัชนี
- 1 ลักษณะของปฏิกิริยาความร้อน
- 1.1 ΔH> 0
- 1.2 ทำให้สภาพแวดล้อมเย็นลง
- 2 สมการ
- 3 ตัวอย่างของปฏิกิริยาดูดความร้อนที่พบบ่อย
- 3.1 การระเหยของน้ำแข็งแห้ง
- 3.2 การอบขนมปังหรือทำอาหาร
- 3.3 การอาบแดด
- 3.4 ปฏิกิริยาของการเกิดไนโตรเจนในบรรยากาศและโอโซน
- 3.5 น้ำด้วยกระแสไฟฟ้า
- 3.6 การสังเคราะห์ด้วยแสง
- 3.7 โซลูชั่นของเกลือบางชนิด
- 3.8 การสลายตัวด้วยความร้อน
- 3.9 แอมโมเนียมคลอไรด์ในน้ำ
- 3.10 โซเดียม triosulfate
- 3.11 เครื่องยนต์รถยนต์
- 3.12 ของเหลวที่เดือด
- 3.13 การปรุงไข่
- 3.14 การปรุงอาหาร
- 3.15 อุ่นอาหารในไมโครเวฟ
- 3.16 การขึ้นรูปแก้ว
- 3.17 การบริโภคเทียน
- 3.18 การทำความสะอาดด้วยน้ำร้อน
- 3.19 การฆ่าเชื้อด้วยความร้อนของอาหารและวัตถุอื่น ๆ
- 3.20 การต่อสู้กับการติดเชื้อที่มีไข้
- 3.21 การระเหยของน้ำ
- 4 อ้างอิง
ลักษณะของปฏิกิริยาดูดความร้อน
การเปลี่ยนสถานะไม่ได้เป็นปฏิกิริยาเคมีอย่างเหมาะสม อย่างไรก็ตามสิ่งเดียวกันเกิดขึ้น: ผลิตภัณฑ์ (น้ำของเหลว) มีพลังงานมากกว่าตัวทำปฏิกิริยา (น้ำแข็ง) นี่คือคุณสมบัติหลักของปฏิกิริยาหรือกระบวนการดูดความร้อน: ผลิตภัณฑ์นั้นมีพลังมากกว่าสารตั้งต้น.
แม้ว่าสิ่งนี้จะเป็นจริง แต่ก็ไม่ได้หมายความว่าผลิตภัณฑ์จะต้องไม่เสถียร ในกรณีที่เป็นปฏิกิริยาดูดความร้อนจะหยุดเกิดขึ้นเองภายใต้อุณหภูมิหรือความดัน.
พิจารณาสมการทางเคมีต่อไปนี้:
A + Q => B
โดยที่ Q แทนความร้อนมักแสดงด้วยหน่วยจูล (J) หรือแคลอรี่ (cal) เนื่องจาก A ดูดซับความร้อน Q เพื่อแปลงเป็น B จึงมีการกล่าวว่ามันเป็นปฏิกิริยาดูดความร้อน ดังนั้น B มีพลังงานมากกว่า A และต้องดูดซับพลังงานที่เพียงพอเพื่อให้เกิดการเปลี่ยนแปลง.
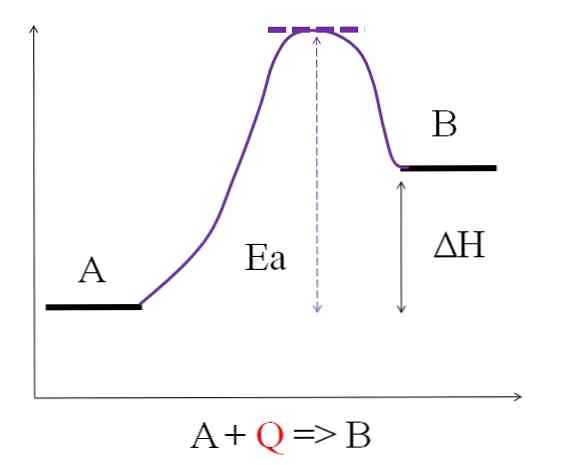
ดังที่เห็นในแผนภาพด้านบน A มีพลังงานน้อยกว่า B จำนวนความร้อน Q ที่ดูดซับ A นั้นจะเอาชนะพลังงานกระตุ้น (พลังงานที่จำเป็นในการเข้าถึงด้านบนสีม่วงพร้อมหลังคาประ) ความแตกต่างของพลังงานระหว่าง A และ B คือสิ่งที่เรียกว่าเอนทาลปีของปฏิกิริยา ,H.
ΔH> 0
ปฏิกิริยาดูดความร้อนทั้งหมดมีเหมือนกันในแผนภาพก่อนหน้าเนื่องจากผลิตภัณฑ์มีพลังมากกว่าสารตั้งต้น ดังนั้นความแตกต่างของพลังงานระหว่างพวกเขาคือΔHจึงเป็นบวกเสมอ (Hสินค้า-Hน้ำยา > 0) เมื่อสิ่งนี้เป็นจริงจะต้องมีการดูดซับความร้อนหรือพลังงานจากสิ่งแวดล้อมเพื่อตอบสนองความต้องการพลังนี้.
และวิธีการตีความเช่นการแสดงออก? ในการเชื่อมโยงปฏิกิริยาทางเคมีจะถูกทำลายเพื่อสร้างคนอื่น ๆ ในการทำลายพวกมันจำเป็นต้องมีการดูดซับพลังงาน นั่นคือมันเป็นข้อความที่ดูดความร้อน ในขณะเดียวกันการก่อตัวของการเชื่อมโยงหมายถึงความมั่นคงดังนั้นจึงเป็นขั้นตอนคายความร้อน.
เมื่อพันธะที่เกิดขึ้นไม่ให้ความเสถียรเทียบเท่ากับปริมาณพลังงานที่ต้องใช้ในการแตกพันธะเก่านี่คือปฏิกิริยาดูดความร้อน นั่นคือเหตุผลที่จำเป็นต้องใช้พลังงานเพิ่มเติมเพื่อส่งเสริมการทำลายพันธะที่เสถียรที่สุดในรีเอเจนต์.
ในทางตรงกันข้ามปฏิกิริยาคายความร้อนเกิดขึ้นตรงกันข้าม: ความร้อนถูกปลดปล่อยออกมาและΔHคือ < 1 (negativo). Aquí los productos son más estables que los reactivos, y el diagrama entre A y B cambia de forma; ahora B se ubica por debajo de A, y la energía de activación es menor.
พวกเขาเย็นโดยรอบ
แม้ว่ามันจะไม่สามารถใช้ได้กับปฏิกิริยาดูดความร้อนทั้งหมด แต่ก็มีหลายสาเหตุที่ทำให้อุณหภูมิของสภาพแวดล้อมลดลง นี่เป็นเพราะความร้อนที่ดูดซับมาจากที่อื่น ดังนั้นหากการแปลง A และ B ถูกนำไปไว้ในคอนเทนเนอร์มันจะเย็นลง.
ยิ่งมีปฏิกิริยาดูดความร้อนมากเท่าไรภาชนะก็จะยิ่งเย็นลงมากขึ้นเท่านั้น ในความเป็นจริงปฏิกิริยาบางอย่างยังสามารถก่อตัวเป็นน้ำแข็งปกคลุมราวกับว่าพวกมันออกมาจากตู้เย็น.
อย่างไรก็ตามมีปฏิกิริยาของประเภทนี้ที่ไม่ทำให้เย็นโดยรอบ ทำไม? เนื่องจากความร้อนของสภาพแวดล้อมไม่เพียงพอ นั่นคือมันไม่ได้จัดเตรียม Q (J, cal) ที่จำเป็นซึ่งเขียนไว้ในสมการทางเคมี ดังนั้นจึงเป็นที่นี่เมื่อไฟหรือรังสีอัลตราไวโอเลตเข้าสู่.
อาจเกิดความสับสนเล็กน้อยระหว่างทั้งสองสถานการณ์ ในอีกด้านหนึ่งความร้อนของสภาพแวดล้อมเพียงพอต่อปฏิกิริยาที่จะเกิดขึ้นเองตามธรรมชาติ และอีกวิธีหนึ่งคือต้องการความร้อนมากขึ้นและใช้วิธีการให้ความร้อนที่มีประสิทธิภาพ ในทั้งสองกรณีสิ่งเดียวกันเกิดขึ้น: พลังงานถูกดูดซับ.
สมการ
สมการที่เกี่ยวข้องในปฏิกิริยาดูดความร้อนคืออะไร? ดังที่ได้อธิบายไปแล้วΔHจะต้องเป็นบวก ในการคำนวณสมการทางเคมีต่อไปนี้ถือเป็นอันดับแรก:
aA + bB => cC + dD
โดยที่ A และ B เป็นสารตั้งต้นและ C และ D เป็นผลิตภัณฑ์ ตัวอักษรตัวเล็ก (a, b, c และ d) เป็นค่าสัมประสิทธิ์ปริมาณสัมพันธ์ ในการคำนวณΔHของปฏิกิริยาทั่วไปจะใช้นิพจน์ทางคณิตศาสตร์ต่อไปนี้:
.DELTA.Hก่อ- .DELTA.Hน้ำยา = ΔHrxn
คุณสามารถดำเนินการโดยตรงหรือทำการคำนวณแยกต่างหาก สำหรับΔHก่อ ต้องคำนวณผลรวมต่อไปนี้:
c ΔHFC + d ΔHFD
อยู่ที่ไหนΔHF มันเป็นเอนทัลปีของการก่อตัวของแต่ละสารที่เกี่ยวข้องในปฏิกิริยา โดยการประชุมสารในรูปแบบที่มั่นคงที่สุดของพวกเขามีΔHF= 0 ตัวอย่างเช่นโมเลกุล O2 และเอช2, หรือโลหะแข็งพวกเขามีΔHF= 0.
การคำนวณแบบเดียวกันนี้เสร็จสิ้นแล้วสำหรับสารตั้งต้นΔHน้ำยา:
ถึงΔHFA + b ΔHFB
แต่ตามที่สมการบอกว่าΔHน้ำยา จะต้องลบออกจากΔHก่อ, ดังนั้นผลรวมก่อนหน้านี้จะต้องคูณด้วย -1 ดังนั้นคุณมี:
c ΔHFC + d ΔHFD - (ถึงΔHFA + b ΔHFB)
หากผลลัพธ์ของการคำนวณนี้เป็นจำนวนบวกแสดงว่าเป็นปฏิกิริยาดูดความร้อน และถ้ามันเป็นลบมันเป็นปฏิกิริยาคายความร้อน.
ตัวอย่างของปฏิกิริยาดูดความร้อนที่พบบ่อย
การระเหยของน้ำแข็งแห้ง

ใครก็ตามที่เคยเห็นไอระเหยสีขาวที่เล็ดลอดออกมาจากรถเข็นไอศครีมได้เห็นตัวอย่างที่พบบ่อยที่สุดตัวอย่างหนึ่งของ "ปฏิกิริยา" ที่ดูดความร้อน.
นอกเหนือจากไอศครีมสองสามไอระเหยเหล่านี้แยกจากของแข็งสีขาวที่เรียกว่าน้ำแข็งแห้งยังเป็นส่วนหนึ่งของสถานการณ์เพื่อสร้างผลกระทบจากหมอกควัน น้ำแข็งแห้งนี้ไม่ได้เป็นอะไรมากไปกว่าคาร์บอนไดออกไซด์ที่เป็นของแข็งซึ่งดูดซับอุณหภูมิและก่อนที่ความดันภายนอกจะเริ่มลดลง.
การทดลองสำหรับผู้ชมเด็กคือการเติมและปิดผนึกถุงด้วยน้ำแข็งแห้ง หลังจากผ่านไปครู่หนึ่งมันจะจบลงด้วยการพองตัวเนื่องจาก CO2 ก๊าซซึ่งสร้างงานหรือกดผนังด้านในของถุงกับความดันบรรยากาศ.
ขนมปังอบหรือทำอาหาร

การอบขนมปังเป็นตัวอย่างของปฏิกิริยาเคมีเนื่องจากขณะนี้มีการเปลี่ยนแปลงทางเคมีเนื่องจากความร้อน ใครก็ตามที่มีกลิ่นหอมของขนมปังอบสดใหม่รู้ว่ามีปฏิกิริยาดูดความร้อนเกิดขึ้น.
แป้งและส่วนผสมทั้งหมดต้องการความร้อนจากเตาอบเพื่อดำเนินการเปลี่ยนแปลงทั้งหมดที่ขาดไม่ได้ในการเป็นขนมปังและแสดงลักษณะทั่วไป.
นอกจากขนมปังแล้วครัวยังเต็มไปด้วยตัวอย่างของปฏิกิริยาความร้อน ใครเป็นคนจัดการกับพวกเขาทุกวัน พาสต้าปรุงอาหาร, เมล็ดอ่อน, อุ่นข้าวโพด, อบไข่, เนื้อสัตว์ปรุงรส, อบเค้ก, ทำชา, แซนวิชร้อน แต่ละกิจกรรมเหล่านี้เป็นปฏิกิริยาดูดความร้อน.
อาบแดด

เรียบง่ายและเป็นเรื่องธรรมดาที่พวกเขาอาจดูเหมือนว่าอาบแดดที่สัตว์เลื้อยคลานบางชนิดใช้เช่นเต่าและจระเข้ตกลงไปในประเภทของปฏิกิริยาดูดความร้อน เต่าดูดซับความร้อนจากดวงอาทิตย์เพื่อควบคุมอุณหภูมิของสิ่งมีชีวิต.
หากไม่มีดวงอาทิตย์พวกเขาจะเก็บความร้อนของน้ำเพื่อให้ร่างกายอบอุ่น สิ่งที่ทำให้น้ำหล่อเย็นในถังหรือตู้ปลาของคุณเย็นลง.
ปฏิกิริยาการเกิดไนโตรเจนในบรรยากาศและโอโซน

อากาศส่วนใหญ่ประกอบด้วยไนโตรเจนและออกซิเจน ในช่วงพายุฝนฟ้าคะนองพลังงานจะถูกปล่อยออกมาซึ่งสามารถทำลายพันธะที่แข็งแกร่งที่ยึดอะตอมไนโตรเจนไว้ในโมเลกุล N ได้2:
ยังไม่มีข้อความ2 + O2 + Q => 2NO
ในทางกลับกันออกซิเจนสามารถดูดซับรังสีอัลตราไวโอเลตให้กลายเป็นโอโซน อัลโลโร่ของออกซิเจนที่มีประโยชน์มากในสตราโตสเฟียร์ แต่เป็นอันตรายต่อชีวิตในระดับพื้นดิน ปฏิกิริยาคือ:
3O2 + v => 2O3
โดยที่ v หมายถึงรังสีอัลตราไวโอเลต กลไกเบื้องหลังสมการง่าย ๆ นั้นซับซ้อนมาก.
น้ำอิเล็กโทรไล
อิเล็กโทรไลซิสใช้พลังงานไฟฟ้าเพื่อแยกโมเลกุลในองค์ประกอบหรือสร้างโมเลกุล ตัวอย่างเช่นในอิเล็กโทรไลซิสของน้ำมีการสร้างก๊าซสองชนิด: ไฮโดรเจนและออกซิเจนแต่ละชนิดในขั้วไฟฟ้าที่แตกต่างกัน:
2H2O => 2H2 + O2
นอกจากนี้โซเดียมคลอไรด์ยังสามารถได้รับปฏิกิริยาเดียวกันนี้:
2NaCl => 2Na + Cl2
ในอิเล็กโทรดหนึ่งคุณจะเห็นการก่อตัวของโซเดียมโลหะและอีกฟองหนึ่งของคลอรีนสีเขียว.
การสังเคราะห์แสง

พืชและต้นไม้จำเป็นต้องดูดซับแสงแดดเป็นพลังงานเพื่อสังเคราะห์วัสดุชีวภาพของพวกเขา สำหรับสิ่งนี้มันใช้ CO เป็นวัตถุดิบ2 และน้ำซึ่งผ่านขั้นตอนยาว ๆ จะถูกเปลี่ยนเป็นน้ำตาลกลูโคสและน้ำตาลอื่น ๆ นอกจากนี้ยังมีออกซิเจนเกิดขึ้นซึ่งถูกปล่อยออกมาจากใบ.
วิธีแก้ปัญหาของเกลือบางอย่าง
หากโซเดียมคลอไรด์ละลายในน้ำจะไม่สังเกตเห็นการเปลี่ยนแปลงของอุณหภูมิภายนอกของภาชนะหรือภาชนะบรรจุ.
เกลือบางชนิดเช่นแคลเซียมคลอไรด์ CaCl2, เพิ่มอุณหภูมิของน้ำเป็นผลิตภัณฑ์ของไฮเดรชั่นอันยิ่งใหญ่ของไอออน Ca2+. และเกลืออื่น ๆ เช่นไนเตรตหรือแอมโมเนียมคลอไรด์ NH4NO3 และ NH4Cl ลดอุณหภูมิของน้ำและทำให้สภาพแวดล้อมเย็นลง.
ในห้องเรียนมักจะทำการทดลองแบบโฮมเมดที่จะละลายเกลือเหล่านี้เพื่อแสดงให้เห็นว่าปฏิกิริยาดูดความร้อนคืออะไร.
การลดลงของอุณหภูมิเกิดจากการไฮเดรชั่นของไอออน NH4+ มันไม่ได้รับการสนับสนุนจากการสลายตัวของผลึกของเกลือเกลือ ดังนั้นเกลือจะดูดซับความร้อนจากน้ำเพื่อให้ไอออนถูกละลาย.
ปฏิกิริยาทางเคมีอื่นที่มักพบบ่อยมากในการแสดงนี้คือ:
บา (OH)2· 8 ชม2O + 2NH4NO3 => Ba (ไม่3)2 + 2NH3 +10H2O
สังเกตปริมาณน้ำที่เกิดขึ้น โดยการผสมของแข็งทั้งสองจะได้สารละลาย Ba ที่เป็นน้ำ (NO3)2, ด้วยกลิ่นของแอมโมเนียและด้วยอุณหภูมิที่ลดลงอย่างแท้จริงที่ค้างพื้นผิวภายนอกของภาชนะ.
การสลายตัวด้วยความร้อน
หนึ่งในการสลายตัวทางความร้อนที่พบมากที่สุดคือโซเดียมไบคาร์บอเนต NaHCO3, ในการผลิต CO2 และน้ำเมื่อถูกความร้อน ของแข็งหลายชนิดรวมถึงคาร์บอเนตมีแนวโน้มที่จะสลายตัวเพื่อปล่อย CO2 และออกไซด์ที่เกี่ยวข้อง ตัวอย่างเช่นการสลายตัวของแคลเซียมคาร์บอเนตเป็นดังนี้:
แคลเซียมคาร์บอเนต3 + Q => CaO + CO2
เช่นเดียวกับแมกนีเซียมสตรอนเทียมและแบเรียมคาร์บอเนต.
เป็นสิ่งสำคัญที่จะต้องทราบว่าการสลายตัวของความร้อนนั้นแตกต่างจากการเผาไหม้ ในครั้งแรกไม่มีการจุดระเบิดหรือความร้อนออกในขณะที่ใช่; นั่นคือการเผาไหม้เป็นปฏิกิริยาคายความร้อนแม้ว่าจะต้องการแหล่งความร้อนเริ่มต้นที่จะเกิดขึ้นหรือเกิดขึ้นเองตามธรรมชาติ.
แอมโมเนียมคลอไรด์ในน้ำ
เมื่อแอมโมเนียมคลอไรด์ (NH4Cl) จำนวนเล็กน้อยละลายในน้ำในหลอดทดลองหลอดจะเย็นกว่าเดิม ในระหว่างปฏิกิริยาทางเคมีนี้ความร้อนจะถูกดูดซับจากสภาพแวดล้อม.
โซเดียม triosulfate
เมื่อผลึกโซเดียมไธโอซัลเฟต (นา2S2O3.5H2O) เรียกว่า hypo ละลายในน้ำจะเกิดความเย็นขึ้น.
เครื่องยนต์ของรถยนต์
การเผาไหม้ของน้ำมันเบนซินหรือดีเซลในเครื่องยนต์ของรถยนต์รถบรรทุกรถแทรกเตอร์หรือรถโดยสารผลิตพลังงานกลซึ่งใช้ในการไหลเวียนของยานพาหนะเหล่านี้.
ของเหลวเดือด
โดยการใส่ของเหลวลงในความร้อนจะได้รับพลังงานและเข้าสู่สถานะเป็นก๊าซ.
ทำอาหารไข่
เมื่อความร้อนถูกนำไปใช้โปรตีนไข่จะถูกทำลายให้กลายเป็นโครงสร้างที่เป็นของแข็งซึ่งมักจะถูกกลืนเข้าไป.
ทำอาหาร
โดยทั่วไปเสมอเมื่อปรุงด้วยความร้อนเพื่อเปลี่ยนคุณสมบัติของอาหารปฏิกิริยาความร้อนที่เกิดขึ้น.
ปฏิกิริยาเหล่านี้เป็นสิ่งที่ทำให้อาหารนิ่มลงสร้างมวลที่อ่อนนุ่มปล่อยส่วนประกอบที่บรรจุอยู่เหนือสิ่งอื่นใด.
อุ่นอาหารในไมโครเวฟ
โดยการแผ่รังสีไมโครเวฟโมเลกุลของน้ำในอาหารดูดซับพลังงานเริ่มสั่นสะเทือนและเพิ่มอุณหภูมิของอาหาร.
แม่พิมพ์แก้ว
การดูดซับความร้อนจากกระจกทำให้ข้อต่อมีความยืดหยุ่นมากขึ้นทำให้เปลี่ยนรูปร่างได้ง่ายขึ้น.
การบริโภคเทียน
เทียนขี้ผึ้งละลายในขณะที่ดูดซับความร้อนของเปลวไฟเปลี่ยนรูปร่าง.
ทำความสะอาดด้วยน้ำร้อน
เมื่อใช้น้ำร้อนในการทำความสะอาดวัตถุที่มีคราบไขมันเช่นหม้อหรือเสื้อผ้าไขมันจะกลายเป็นของเหลวมากขึ้นและง่ายต่อการกำจัด.
ความร้อนฆ่าเชื้อของอาหารและวัตถุอื่น ๆ
เมื่อทำความร้อนวัตถุหรืออาหารจุลินทรีย์ที่มีอยู่จะเพิ่มอุณหภูมิ.
เมื่อมีการให้ความร้อนจำนวนมากปฏิกิริยาภายในเซลล์จุลินทรีย์จะเกิดขึ้น ปฏิกิริยาเหล่านี้หลายอย่างเช่นการทำลายพันธะหรือการสูญเสียโปรตีนทำให้เกิดการฆ่าเชื้อจุลินทรีย์.
ต่อสู้กับการติดเชื้อที่มีไข้
เมื่อมีไข้ปรากฏตัวมันเป็นเพราะร่างกายผลิตความร้อนที่จำเป็นในการฆ่าเชื้อแบคทีเรียและไวรัสที่ทำให้เกิดการติดเชื้อและสร้างโรค.
หากความร้อนที่เกิดขึ้นสูงและมีไข้สูงเซลล์ของร่างกายจะได้รับผลกระทบและมีความเสี่ยงต่อการเสียชีวิต.
การระเหยของน้ำ
เมื่อน้ำระเหยและเปลี่ยนเป็นไอน้ำมันจะเกิดจากความร้อนที่ได้รับจากสิ่งแวดล้อม เมื่อได้รับพลังงานความร้อนจากน้ำแต่ละโมเลกุลพลังงานการสั่นสะเทือนของมันจะเพิ่มขึ้นจนถึงจุดที่สามารถเคลื่อนที่ได้อย่างอิสระสร้างไอ.
การอ้างอิง
- Whitten, Davis, Peck & Stanley (2008) เคมี (8th ed.) CENGAGE การเรียนรู้.
- วิกิพีเดีย (2018) กระบวนการดูดความร้อน สืบค้นจาก: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (27 ธันวาคม 2018) ตัวอย่างปฏิกิริยาความร้อน ดึงมาจาก: thoughtco.com
- Khan Academy (2019) Endothermic vs. ปฏิกิริยาคายความร้อน สืบค้นจาก: khanacademy.org
- Serm Murmson (2019) เกิดอะไรขึ้นกับระดับโมเลกุลระหว่างปฏิกิริยาดูดความร้อน? เฮิร์สต์สื่อซีแอตเติล สืบค้นจาก: education.seattlepi.com
- QuimiTube (2013) การคำนวณเอนทาลปีของปฏิกิริยาจากเอนทาลปีของการก่อตัว ดึงมาจาก: quimitube.com
- Quimicas.net (2018) ตัวอย่างของปฏิกิริยาความร้อน ดึงมาจาก:
quimicas.net.


