ลักษณะและข้อ จำกัด ของแบบจำลอง Broglie Atomic
แบบจำลองปรมาณู Broglie ถูกเสนอโดยนักฟิสิกส์ชาวฝรั่งเศส Louis Broglie ในปี 1924 ในวิทยานิพนธ์ปริญญาเอกของเขา Broglie ยืนยันความเป็นคู่ของคลื่นอนุภาคของอิเล็กตรอนวางรากฐานของกลศาสตร์คลื่น Broglie ตีพิมพ์ผลการวิจัยทางทฤษฎีที่สำคัญเกี่ยวกับธรรมชาติของคลื่นวัตถุในระดับอะตอม.
ต่อจากนั้นคำแถลงของ Broglie ถูกทดลองโดยนักวิทยาศาสตร์ Clinton Davisson และ Lester Germer ในปี 1927 ทฤษฎีคลื่น Broglie อิเล็กตรอนขึ้นอยู่กับข้อเสนอของ Einstein ต่อคุณสมบัติคลื่นของแสงที่ความยาวคลื่นสั้น.
Broglie ประกาศความเป็นไปได้ที่สสารมีพฤติกรรมคล้ายกับแสงและแนะนำคุณสมบัติที่คล้ายกันในอนุภาคของอะตอมเช่นอะตอม.
ประจุไฟฟ้าและวงโคจรจำกัดความกว้างความยาวและความถี่ของคลื่นที่อธิบายโดยอิเล็กตรอน Broglie อธิบายการเคลื่อนที่ของอิเล็กตรอนรอบนิวเคลียสของอะตอม.
ดัชนี
- 1 ลักษณะของแบบจำลองอะตอมของ Broglie
- 2 การทดสอบ Davisson และ Germer
- 3 ข้อ จำกัด
- 4 บทความที่น่าสนใจ
- 5 อ้างอิง
ลักษณะของแบบจำลองอะตอมของ Broglie
เพื่อพัฒนาข้อเสนอของเขา Broglie เริ่มต้นจากหลักการที่ว่าอิเล็กตรอนมีลักษณะสองอย่างระหว่างคลื่นและอนุภาคคล้ายกับแสง.
ในแง่นี้ Broglie ทำการเปรียบเทียบระหว่างปรากฏการณ์ทั้งสองและบนพื้นฐานของสมการที่พัฒนาโดย Einstein สำหรับการศึกษาลักษณะคลื่นของแสงเขาระบุสิ่งต่อไปนี้:
- พลังงานทั้งหมดของโฟตอนและดังนั้นพลังงานทั้งหมดของอิเล็กตรอนเป็นผลมาจากผลลัพธ์ของความถี่ของคลื่นและค่าคงที่ของแผ่นไม้ (6.62606957 (29) × 10 -34 Jules x วินาที) ตามรายละเอียดในนิพจน์ต่อไปนี้:
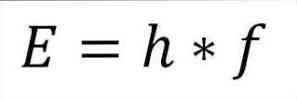
ในการแสดงออกนี้:
E = พลังงานอิเล็กตรอน.
h = ค่าคงที่ของแผ่นไม้.
f = ความถี่ของคลื่น.
- ช่วงเวลาเชิงเส้นของโฟตอนและของอิเล็กตรอนนั้นแปรผกผันกับความยาวคลื่นและขนาดทั้งสองมีความสัมพันธ์กันผ่านค่าคงที่ของกระดาน:
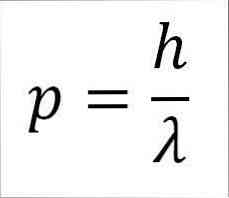
ในการแสดงออกนี้:
p = โมเมนต์เชิงเส้นของอิเล็กตรอน.
h = ค่าคงที่ของแผ่นไม้.
λ = ความยาวคลื่น.
- โมเมนตัมเชิงเส้นเป็นผลผลิตของมวลของอนุภาคด้วยความเร็วที่อนุภาคมีระหว่างการเคลื่อนที่.
หากการแสดงออกทางคณิตศาสตร์ก่อนหน้านี้ได้รับการปรับโครงสร้างให้เป็นฟังก์ชันของความยาวคลื่นเราจะมีสิ่งต่อไปนี้:
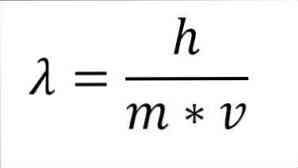
ในการแสดงออกดังกล่าว:
λ = ความยาวคลื่น.
h = ค่าคงที่ของแผ่นไม้.
m = มวลของอิเล็กตรอน.
v = ความเร็วของอิเล็กตรอน.
เนื่องจาก h, ค่าคงที่ของ Plank, มีค่าเพียงเล็กน้อย, ความยาวคลื่นλก็เช่นกัน ดังนั้นจึงเป็นไปได้ที่จะระบุว่าคุณสมบัติคลื่นของอิเล็กตรอนเกิดขึ้นเฉพาะที่ระดับอะตอมและระดับอะตอม.
- Broglie ยังขึ้นอยู่กับสมมุติฐานของแบบจำลองอะตอมของ Bohr ตามหลังวงโคจรของอิเล็กตรอนถูก จำกัด และสามารถเป็นจำนวนเต็มของจำนวนเต็มเท่านั้น ดังนี้:
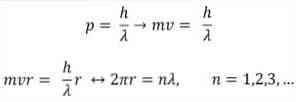
ที่อยู่:
λ = ความยาวคลื่น.
h = ค่าคงที่ของแผ่นไม้.
m = มวลของอิเล็กตรอน.
v = ความเร็วของอิเล็กตรอน.
r = รัศมีของวงโคจร.
n = จำนวนเต็ม.
ตามแบบจำลองของอะตอม Bohr ซึ่ง Broglie นำมาใช้เป็นพื้นฐานหากอิเล็กตรอนทำตัวเหมือนคลื่นนิ่งวงโคจรที่ได้รับอนุญาตเพียงอย่างเดียวคือวงโคจรที่มีรัศมีเท่ากับความหลากหลายของความยาวคลื่น.
ดังนั้นวงโคจรทั้งหมดจึงไม่ตรงกับพารามิเตอร์ที่จำเป็นสำหรับอิเล็กตรอนในการเคลื่อนที่ผ่านมัน นั่นเป็นสาเหตุที่อิเล็กตรอนสามารถเคลื่อนที่ในวงโคจรที่เฉพาะเจาะจงได้.
ทฤษฎีคลื่นของอิเล็กตรอน Broglie แสดงให้เห็นถึงความสำเร็จของแบบจำลองอะตอมบอร์เพื่ออธิบายพฤติกรรมของอิเล็กตรอนเดี่ยวของอะตอมไฮโดรเจน.
มันยังทำให้เข้าใจได้ว่าทำไมรูปแบบนี้ไม่เหมาะกับระบบที่ซับซ้อนมากขึ้นนั่นคืออะตอมที่มีอิเล็กตรอนมากกว่าหนึ่งตัว.
การทดลอง Davisson และ Germer
การตรวจสอบการทดลองของแบบจำลองอะตอมของ Broglie เกิดขึ้น 3 ปีหลังจากการตีพิมพ์ในปี 1927.
นักฟิสิกส์ชาวอเมริกันผู้โด่งดัง Clinton J. Davisson และ Lester Germer ยืนยันการทดลองทฤษฎีของกลศาสตร์คลื่น.
Davisson และ Germer ทำการทดสอบการกระเจิงของลำอิเล็กตรอนผ่านคริสตัลนิกเกิลและสังเกตปรากฏการณ์การเลี้ยวเบนผ่านตัวกลางโลหะ.
การทดลองที่ดำเนินการประกอบด้วยขั้นตอนต่อไปนี้:
- ในตัวอย่างแรกมีการประกอบชุดลำแสงอิเล็กตรอนที่มีพลังงานเริ่มต้นที่รู้จัก.
- มีการติดตั้งแหล่งจ่ายแรงดันเพื่อเร่งการเคลื่อนที่ของอิเล็กตรอนกระตุ้นให้เกิดความต่างศักย์.
- การไหลของลำอิเล็กตรอนพุ่งตรงไปยังคริสตัลโลหะ ในกรณีนี้นิกเกิล.
- วัดจำนวนอิเล็กตรอนที่ส่งผลกระทบต่อคริสตัลนิกเกิล.
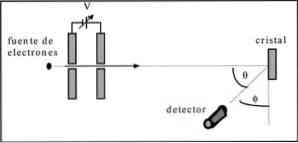
ในตอนท้ายของการทดลอง Davisson และ Germer ตรวจพบว่าอิเล็กตรอนถูกกระจายไปในทิศทางที่ต่างกัน.
ด้วยการทดลองซ้ำโดยใช้ผลึกโลหะที่มีทิศทางต่างกันนักวิทยาศาสตร์ตรวจพบสิ่งต่อไปนี้:
- การกระจายตัวของลำอิเล็กตรอนผ่านคริสตัลโลหะนั้นเปรียบได้กับปรากฏการณ์ของการแทรกสอดและการกระเจิงของแสง.
- การสะท้อนของอิเล็กตรอนในคริสตัลกระทบนั้นอธิบายวิถีที่ในทางทฤษฎีควรอธิบายตามทฤษฎีของคลื่นอิเล็กตรอนของ Broglie.
ในการสังเคราะห์การทดลองของ Davisson และ Germer นั้นได้พิสูจน์ให้เห็นถึงธรรมชาติของคลื่นคู่ - อนุภาคของอิเล็กตรอน.
ข้อ จำกัด
แบบจำลองอะตอมของ Broglie ไม่ได้ทำนายตำแหน่งที่แน่นอนของอิเล็กตรอนในวงโคจรที่มันเคลื่อนที่.
ในแบบจำลองนี้อิเล็กตรอนถูกมองว่าเป็นคลื่นที่เคลื่อนที่รอบวงโคจรโดยไม่มีตำแหน่งเฉพาะซึ่งแนะนำแนวคิดของวงโคจรอิเล็กทรอนิกส์.
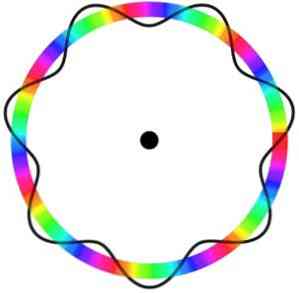
นอกจากนี้แบบจำลองอะตอมของ Broglie ซึ่งคล้ายกับแบบจำลองของSchrödingerไม่ได้พิจารณาการหมุนของอิเล็กตรอนบนแกนของมัน (ปั่น).
ด้วยการเพิกเฉยต่อโมเมนตัมเชิงมุมที่แท้จริงของอิเล็กตรอนการเปลี่ยนแปลงเชิงพื้นที่ของอนุภาค subatomic เหล่านี้จึงถูกละเลย.
ในลำดับความคิดเดียวกันโมเดลนี้ไม่ได้คำนึงถึงการเปลี่ยนแปลงพฤติกรรมของอิเล็กตรอนที่เร็วซึ่งเป็นผลมาจากผลกระทบเชิงสัมพัทธภาพ.
บทความที่น่าสนใจ
แบบจำลองอะตอมของSchrödinger.
แบบจำลองอะตอมของ Chadwick.
แบบจำลองอะตอมของไฮเซนเบิร์ก.
แบบจำลองอะตอมของเพอร์ริน.
แบบจำลองอะตอมของทอมสัน.
แบบจำลองอะตอมของดาลตัน.
แบบจำลองอะตอมของ Dirac Jordan.
แบบจำลองอะตอมของพรรคประชาธิปัตย์.
แบบจำลองอะตอมของ Bohr.
การอ้างอิง
- ทฤษฎีควอนตัมของ Bohr และคลื่น De Broglie (s.f. ) สืบค้นจาก: ne.phys.kyushu-u.ac.j
- หลุยส์เดอ Broglie - ชีวประวัติ (2472) ©มูลนิธิโนเบล สืบค้นจาก: nobelprize.org
- Louis-Victor de Broglie (s.f. ) สืบค้นจาก: chemed.chem.purdue.edu
- เฟวท, B. (1998) Louis de Broglie สารานุกรม Britannica, Inc. สืบค้นจาก: britannica.com
- แบบจำลองอะตอมของ De Broglie การศึกษาทางไกลมหาวิทยาลัยแห่งชาติ. สเปน ดึงจาก: ocw.innova.uned.es
- เรื่องคลื่นของ Louis De Broglie (s.f. ) สืบค้นจาก: hiru.eus
- Von Pamel, O. และ Marchisio, S. (s.f. ) กลศาสตร์ควอนตัม มหาวิทยาลัยแห่งชาติโรซาริโอ ดึงจาก: fceia.unr.edu.ar


