แบบจำลองอะตอมของดัลตันสมมุติฐาน
แบบจำลองอะตอมของดาลตันหรือ ทฤษฎีอะตอมของดาลตัน, มันเป็นข้อเสนอที่นำเสนอระหว่างปี 1803 ถึง 1807 โดยนักเคมีชาวอังกฤษและนักคณิตศาสตร์จอห์นดัลตัน นี่เป็นข้อเสนอแรกขององค์กรที่มีแนวคิดเกี่ยวกับโครงสร้างและหน้าที่ของอะตอม.
แบบจำลองดาลตันเป็นที่รู้จักกันในอีกชื่อหนึ่งว่าแบบจำลองทรงกลมเนื่องจากมันเสนอข้อเท็จจริงที่ว่าอะตอมนั้นเป็นทรงกลมที่แยกไม่ออกแข็งและกะทัดรัด ต้องขอบคุณแบบจำลองนี้มันง่ายกว่ามากที่จะให้คำอธิบายเกี่ยวกับเคมีให้กับส่วนที่เหลือของโลกและเป็นพื้นฐานของโครงการวิจัยที่เป็นนวัตกรรมมากมายที่ตามมา สามารถอธิบายได้ว่าทำไมสารมีปฏิกิริยาในบางสถานะ.
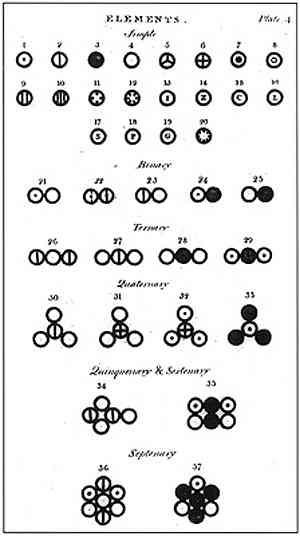
อ้างอิงจากสดัลตันสสารประกอบด้วยหน่วยที่เล็กที่สุดที่เรียกว่าอะตอมซึ่งไม่สามารถทำลายหรือแบ่งได้ แต่อย่างใด หน่วยนี้ซึ่งก่อนหน้านี้เสนอโดย Democritus และที่ปรึกษา Leucipo ของเขาเป็นพื้นฐานของการวิจัยของดาลตันและการสร้างแบบจำลองอะตอมของเขา.
ด้วยทฤษฎีปรมาณูจอห์นดาลตันพยายามหาแนวคิดของนักปรัชญาชาวกรีกเกี่ยวกับการดำรงอยู่ของอะตอม (ทฤษฎีอะตอมของจักรวาล) แต่ใช้เป็นแพลตฟอร์มการทดลองทางห้องปฏิบัติการที่อนุญาตให้เขาแสดงความคิดของเขา.
ดัชนี
- 1 สมมุติฐานของแบบจำลองอะตอมดัลตัน
- 1.1 สมมุติ 1
- 1.2 สมมุติ 2
- 1.3 สมมุติ 3
- 1.4 สมมุติ 4
- 1.5 สมมุติ 5
- 1.6 สมมุติ 6
- 2 ข้อผิดพลาดของตัวแบบ Atomic ของ Dalton
- 2.1 สูตรน้ำ
- 2.2 องค์ประกอบของอะตอม
- 3 บทสรุป
- 4 การมีส่วนร่วมหลักของดาลตัน
- 4.1 ผู้ตั้งทฤษฎีอะตอม
- 4.2 เขาวางรากฐานของวิชาเคมีสมัยใหม่
- 4.3 ก่อนอื่นให้เผยแพร่ตารางน้ำหนักเคมี
- 4.4 ตั้งชื่อให้ตาบอดสี
- 5 บทความที่น่าสนใจ
- 6 อ้างอิง
สมมุติฐานของแบบจำลองอะตอมดัลตัน
ดัลตันได้สร้างแบบจำลองอะตอมของเขาขึ้นด้วย 6 ข้อซึ่งเขาอธิบายว่าเขาใช้การศึกษาของเขาอย่างไรและทำอย่างไร.
สมมุติ 1

ในภาพด้านบนจะมีการสรุปแบบจำลองของดาลตัน: อะตอมจะเป็นทรงกลมเล็ก ๆ ที่แยกไม่ออกทำลายไม่ได้และเป็นเนื้อเดียวกัน.
สมมุติแรกของดัลตันระบุว่าองค์ประกอบนั้นประกอบด้วยอนุภาคเล็ก ๆ ที่เรียกว่าอะตอมซึ่งไม่สามารถแบ่งได้และไม่สามารถถูกทำลายได้.
ดาลตันให้ความเห็นว่าอนุภาคเหล่านี้ไม่สามารถเปลี่ยนแปลงปฏิกิริยาทางเคมีใด ๆ ได้.
สมมุติ 2

หลักฐานที่สองของดาลตันยอมรับว่าอะตอมทั้งหมดที่มีอยู่ในธาตุเดียวกันมีน้ำหนักเท่ากันในลักษณะอื่น ๆ.
ในอีกทางหนึ่งมันก็เป็นที่ยอมรับว่าอะตอมของธาตุต่าง ๆ มีมวลต่างกัน จากข้อเสนอนี้เกิดขึ้นความรู้เกี่ยวกับน้ำหนักปรมาณูสัมพัทธ์ที่แสดงให้เห็นเมื่อเปรียบเทียบองค์ประกอบที่แตกต่างกับไฮโดรเจน.
สมมุติ 3

สัจพจน์ประการที่สามของดาลตันยอมรับว่าอะตอมจะไม่สามารถแยกออกได้แม้ว่าจะรวมกันในปฏิกิริยาเคมี ไม่สามารถสร้างหรือทำลายได้.
การรวมกันของอะตอมทั้งเท่าและต่างกันจะสร้างสารประกอบที่ซับซ้อนมากขึ้น แต่กระบวนการนี้จะไม่เปลี่ยนความจริงที่ว่าอะตอมเป็นหน่วยขั้นต่ำของสสาร.
สมมุติ 4
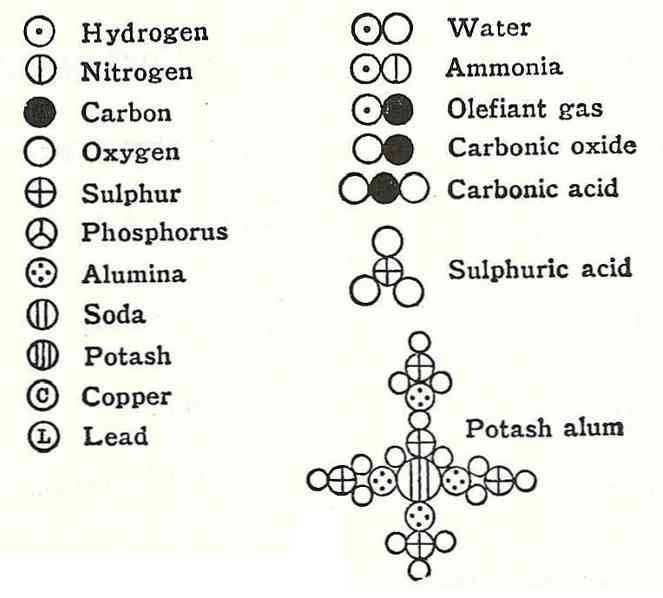
สัจพจน์ประการที่สี่ของดาลตันยอมรับว่าแม้เมื่อรวมอะตอมเข้าด้วยกันเป็นสารประกอบพวกเขาก็จะมีความสัมพันธ์ที่สามารถแสดงเป็นตัวเลขที่เรียบง่ายและสมบูรณ์ได้เสมอ การแสดงออกนี้จะไม่แสดงเป็นเศษส่วนเนื่องจากอะตอมจะมองไม่เห็น.
สมมุติ 5
สมมุติฐานข้อที่ห้าของ Dalton ระบุว่าอาจมีการรวมกันของอะตอมที่แตกต่างกันในสัดส่วนที่แตกต่างกันเพื่อสร้างสารประกอบมากกว่าหนึ่ง.
ด้วยวิธีนี้อาจอธิบายได้ว่าจากอะตอมจำนวน จำกัด ทั้งหมดที่มีอยู่ในเอกภพได้มาถึงแล้ว.
สมมุติ 6
จุดที่หกและสุดท้ายของ Dalton ระบุไว้ว่าสารประกอบทางเคมีแต่ละอันถูกสร้างขึ้นจากการรวมกันของอะตอมของธาตุสองชนิดหรือมากกว่านั้น.
ข้อผิดพลาดของตัวแบบดัลตันอะตอม
เช่นเดียวกับทฤษฏีทั้งหมดในโลกของวิทยาศาสตร์มีการ refutations มากมายเกี่ยวกับแบบจำลองที่เสนอโดย Dalton ซึ่งแสดงให้เห็นในช่วงหลายปีที่ผ่านมาทิ้งไว้ข้างหลังความคิดสร้างสรรค์ของดาลตัน.
สูตรน้ำ
ตัวอย่างของเรื่องนี้คือข้อโต้แย้งที่ดัลตันให้ไว้ในสูตรน้ำซึ่งเขาบอกว่าประกอบด้วยไฮโดรเจนและออกซิเจน.
เนื่องจากคำแถลงนี้มีข้อผิดพลาดมากมายในการคำนวณเกี่ยวกับมวลและน้ำหนักของสารประกอบพื้นฐานบางอย่างที่อยู่บนพื้นฐานของข้อมูลนั้น.
ไม่กี่ปีต่อมานักวิทยาศาสตร์ชาวยุโรป Gay-Lussac และ Alexander von Humbodt ได้ข้องแวะข้อมูลนี้และพิสูจน์ว่าน้ำนั้นประกอบไปด้วยไฮโดรเจนสองตัวและออกซิเจนหนึ่งอัน 6 ปีต่อมา Amadeo Avogadro ชี้ให้เห็นองค์ประกอบที่แน่นอนของน้ำและเพราะมันมีกฎหมายของ Avogadro.
องค์ประกอบของอะตอม
ในอีกทางหนึ่งในศตวรรษที่ยี่สิบองค์ประกอบที่แท้จริงของอะตอมถูกเปิดเผย ในกรณีนี้มันแสดงให้เห็นว่ามีหน่วยที่เล็กกว่าเช่นโปรตอนอิเล็กตรอนและนิวตรอน.
ในทำนองเดียวกันการมีอยู่ของน้ำหนักปรมาณูที่แตกต่างกันที่จัดตั้งขึ้นในตารางธาตุของ Mendeleev และ Meyer, การมีอยู่ของไอโซโทปและคุณสมบัติทางเคมีที่เฉพาะเจาะจงมากขึ้นมา.
ข้อสรุป
แม้จะมีข้อผิดพลาดของเขาการมีส่วนร่วมของ John Dalton มีความเกี่ยวข้องอย่างมากในโลกของวิทยาศาสตร์และทำให้เกิดความตื่นเต้นในเวลาของเขาเนื่องจากข้อมูลจำนวนมากที่เขาให้.
ผลงานทางวิทยาศาสตร์ของคุณยังคงใช้ได้และยังอยู่ระหว่างการศึกษา.
แบบจำลองอะตอมของดาลตันไม่ได้ถูกถามมานานหลายทศวรรษเนื่องจากความเกี่ยวข้องในโลกของวิทยาศาสตร์และคำอธิบายที่ถูกต้องในการสืบสวนและสมมติฐานที่นำเสนอในช่วงเวลานั้นในประวัติศาสตร์วิทยาศาสตร์.
การมีส่วนร่วมหลักของดาลตัน
การมีส่วนร่วมของเขาในโลกแห่งวิทยาศาสตร์เป็นหลักในการชี้แจงและกำหนดสมมติฐานเกี่ยวกับธรรมชาติผ่านการทดสอบเชิงปริมาณ.
นักวิทยาศาสตร์เสียชีวิตด้วยอาการหัวใจวายเมื่อวันที่ 27 กรกฎาคม 1884 ในแมนเชสเตอร์และหลังจากนั้นไม่นานก็ได้รับเกียรติจากสถาบันพระมหากษัตริย์.
สารตั้งต้นของทฤษฎีอะตอม
John Dalton เป็นนักเคมีนักคณิตศาสตร์และนักเคมีชาวอังกฤษ เขาเกิดเมื่อวันที่ 6 กันยายน ค.ศ. 1766 ที่คัมเบอร์แลนด์สหราชอาณาจักรและเป็นที่รู้จักในฐานะหนึ่งในผู้นำของทฤษฎีอะตอมตั้งแต่วินาทีที่เขานำเสนอแบบจำลองอะตอมของเขา.
เขาวางรากฐานของเคมียุคใหม่
ดาลตันเป็นที่รู้จักในฐานะหนึ่งในผู้บุกเบิกในการสร้างตารางน้ำหนักสัมพัทธ์สำหรับองค์ประกอบทางเคมี ความจริงนี้ช่วยวางรากฐานของสิ่งที่เรารู้ในวันนี้ว่าเป็นเคมียุคใหม่.
ก่อนอื่นให้เผยแพร่ตารางน้ำหนักเคมี
ดัลตันเป็นนักวิทยาศาสตร์คนแรกที่ได้รับเกียรติจากการเผยแพร่ตารางน้ำหนักอะตอมซึ่งรวมถึงองค์ประกอบต่างๆเช่นไฮโดรเจน, ออกซิเจน, ฟอสฟอรัส, คาร์บอนและกำมะถัน ขอขอบคุณสิ่งพิมพ์นี้ที่ดัลตันเริ่มทำงานและปั้นแบบจำลองอะตอมของเขาว่าจะเป็นอย่างไร.
ตั้งชื่อให้ตาบอดสี
ควรสังเกตว่าดัลตันเป็นหนึ่งในคนแรก ๆ ที่ลงทะเบียนกับปัญหาทางสายตาในการจับภาพสีและด้วยเหตุนี้สภาพนี้ถูกตั้งชื่อเป็นตาบอดสี.
บทความที่น่าสนใจ
แบบจำลองอะตอมของSchrödinger.
แบบจำลองอะตอมของ Broglie.
แบบจำลองอะตอมของ Chadwick.
แบบจำลองอะตอมของไฮเซนเบิร์ก.
แบบจำลองอะตอมของเพอร์ริน.
แบบจำลองอะตอมของทอมสัน.
แบบจำลองอะตอมของ Dirac Jordan.
แบบจำลองอะตอมของพรรคประชาธิปัตย์.
แบบจำลองอะตอมของ Bohr.
การอ้างอิง
- ทฤษฎีอะตอมของดาลตัน สืบค้นเมื่อวันที่ 24 พฤศจิกายน 2017 จาก Khanacademy: www.khanacademy.org
- ทฤษฎีอะตอมของดาลตัน สืบค้นเมื่อ 24 พฤศจิกายน 2017, จาก Indiana University Northwest: iun.edu
- ทฤษฎีปรมาณู สืบค้นเมื่อวันที่ 24 พฤศจิกายน 2017 จากEncyclopædia Britannica: www.britannica.com
- ทฤษฎีปรมาณู สืบค้นเมื่อวันที่ 24 พฤศจิกายน 2017 จาก Wikipedia: en.wikipedia.org
- ประวัติโครงสร้างอะตอม สืบค้นเมื่อวันที่ 24 พฤศจิกายน 2017 จาก Lumen: courses.lumenlearning.com.


