ประเภทและตัวอย่างของเรขาคณิตโมเลกุล
เรขาคณิตโมเลกุล หรือ โครงสร้างโมเลกุล คือการกระจายตัวของอะตอมรอบ ๆ อะตอมกลาง อะตอมเป็นตัวแทนของภูมิภาคที่มีความหนาแน่นของอิเลคทรอนิกส์สูงและถือว่าเป็นกลุ่มอิเล็กทรอนิกส์.
แนวคิดนี้เกิดจากการรวมกันและข้อมูลการทดลองของสองทฤษฎี: ของวาเลนซ์บอนด์ (TEV) และแรงผลักของคู่อิเลคทรอนิกส์ของเปลือกวาเลนซ์ (VSPR) ในขณะที่แรกกำหนดลิงค์และมุมของพวกเขาที่สองกำหนดรูปทรงเรขาคณิตและดังนั้นโครงสร้างโมเลกุล.

โมเลกุลรูปทรงเรขาคณิตใดที่สามารถนำมาใช้ได้? ทฤษฎีก่อนหน้าทั้งสองให้คำตอบ ตาม VSEPR อะตอมและคู่ของอิเล็กตรอนอิสระจะต้องถูกจัดเรียงในพื้นที่ในลักษณะที่จะลดแรงผลักไฟฟ้าสถิตระหว่างพวกเขา.
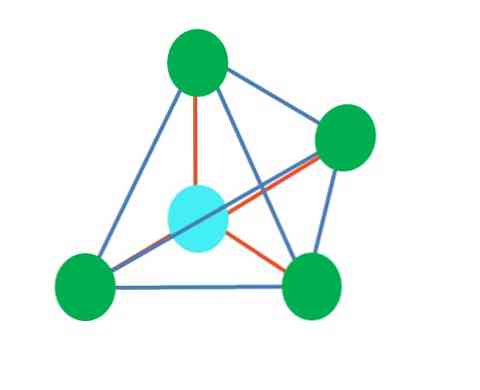
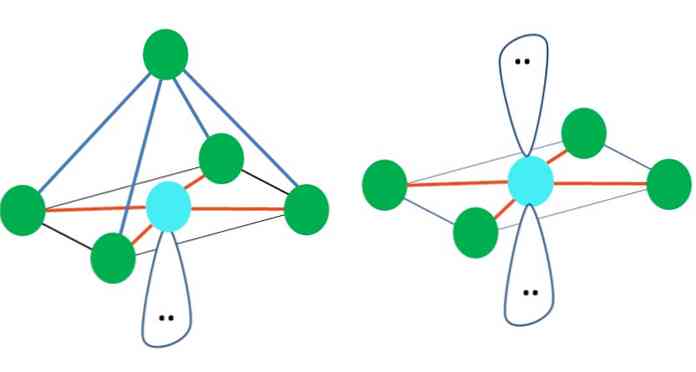
ดังนั้นรูปทรงเรขาคณิตไม่ได้มีจุดมุ่งหมาย แต่มองหาการออกแบบที่เสถียรที่สุด ตัวอย่างเช่นในภาพด้านบนจะเห็นรูปสามเหลี่ยมทางด้านซ้ายและรูปแปดด้านทางด้านขวา จุดสีเขียวแสดงถึงอะตอมและแถบสีส้มเป็นตัวเชื่อมโยง.
ในรูปสามเหลี่ยมจุดสีเขียวสามจุดนั้นจะเน้นที่การแยก120º มุมนี้ซึ่งเท่ากับพันธะช่วยให้อะตอมขับไล่กันน้อยที่สุด ดังนั้นโมเลกุลที่มีอะตอมกลางติดอยู่กับอีกสามโมเลกุลจะนำรูปทรงเรขาคณิตระนาบตรีโกณมิติมาใช้.
อย่างไรก็ตาม VSCR คาดการณ์ว่าอิเล็กตรอนอิสระคู่หนึ่งในอะตอมกลางจะบิดเบือนเรขาคณิต สำหรับกรณีของระนาบตรีโกณมิติคู่นี้จะกดจุดสีเขียวสามจุดลงทำให้เกิดเรขาคณิตปิรามิดแบบสามเหลี่ยม.
สิ่งเดียวกันสามารถเกิดขึ้นได้กับรูปแปดด้านของภาพ ในนั้นอะตอมทั้งหมดจะถูกแยกออกในทางที่มั่นคงที่สุดเท่าที่จะเป็นไปได้.
ดัชนี
- 1 จะรู้ได้อย่างไรว่าเรขาคณิตโมเลกุลของอะตอม X ล่วงหน้าแล้ว?
- 2 ประเภท
- 2.1 Linear
- 2.2 เชิงมุม
- 2.3 Tetrahedral
- 2.4 Trigonal Bipyramid
- 2.5 Octahedral
- 2.6 รูปทรงโมเลกุลอื่น ๆ
- 3 ตัวอย่าง
- 3.1 เรขาคณิตเชิงเส้น
- 3.2 เรขาคณิตเชิงมุม
- 3.3 แผนตรีโกณมิติ
- 3.4 Tetrahedral
- 3.5 พีระมิดตรีโกณมิติ
- 3.6 Bipyramid ตรีโกณมิติ
- 3.7 การสั่น
- 3.8 รูปร่างของ T
- 3.9 Octahedral
- 4 อ้างอิง
จะทราบได้อย่างไรว่าเรขาคณิตโมเลกุลของอะตอม X ล่วงหน้า?
สำหรับสิ่งนี้จำเป็นต้องพิจารณาคู่ของอิเล็กตรอนอิสระเป็นกลุ่มอิเล็กทรอนิกส์ สิ่งเหล่านี้พร้อมกับอะตอมจะกำหนดสิ่งที่เรียกว่า เรขาคณิตอิเล็กทรอนิกส์, ซึ่งเป็นสหายที่แยกออกไม่ได้ของเรขาคณิตโมเลกุล.
จากรูปทรงอิเล็คทรอนิคส์และจากการที่โครงสร้างของลูอิสตรวจพบคู่ของอิเล็กตรอนอิสระเราสามารถกำหนดรูปทรงของโมเลกุลได้ ผลรวมของรูปทรงโมเลกุลทั้งหมดจะเป็นโครงร่างของโครงสร้างระดับโลก.
ชนิด
ดังที่เห็นในภาพหลักเรขาคณิตโมเลกุลขึ้นอยู่กับจำนวนอะตอมที่ล้อมรอบอะตอมกลาง อย่างไรก็ตามหากมีอิเลคตรอนคู่หนึ่งอยู่โดยไม่มีการแบ่งปันมันจะแก้ไขรูปทรงเรขาคณิตเพราะมันมีปริมาณมาก ดังนั้นจึงออกแรงผล steric.
จากข้อมูลนี้เรขาคณิตสามารถนำเสนอชุดของรูปร่างที่เป็นลักษณะสำหรับโมเลกุลจำนวนมาก และนี่คือที่ซึ่งโมเลกุลประเภทต่าง ๆ หรือโครงสร้างโมเลกุลเกิดขึ้น.
เมื่อเรขาคณิตเท่ากับโครงสร้าง? ทั้งสองแสดงว่าเหมือนกันเฉพาะในกรณีที่โครงสร้างไม่มีเรขาคณิตมากกว่าหนึ่งประเภท มิฉะนั้นประเภทปัจจุบันทั้งหมดจะต้องได้รับการพิจารณาและโครงสร้างที่ให้ชื่อทั่วโลก (เชิงเส้น, กิ่ง, กลม, แบน ฯลฯ ).
รูปทรงเรขาคณิตมีประโยชน์อย่างยิ่งในการอธิบายโครงสร้างของของแข็งจากหน่วยโครงสร้าง.
เชิงเส้น
พันธะโควาเลนต์ทั้งหมดเป็นทิศทางดังนั้นลิงก์ A-B จึงเป็นเส้นตรง แต่โมเลกุล AB จะเป็นเส้นตรงหรือไม่2? ถ้าใช่รูปทรงเรขาคณิตนั้นจะแสดงเพียง: B-A-B อะตอม B สองตัวถูกแยกด้วยมุม 180 °และตาม TEV นั้น A จะต้องมีวงโคจรผสมไฮบริด.
เชิงมุม
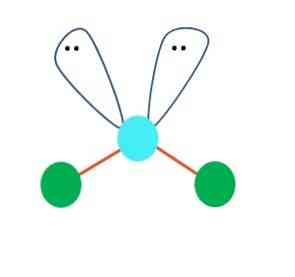
มันสามารถสันนิษฐานได้ในตัวอย่างแรกคือเรขาคณิตเชิงเส้นสำหรับโมเลกุล AB2; แม้กระนั้นมันเป็นสิ่งจำเป็นที่จะต้องวาดโครงสร้างของลูอิสก่อนถึงข้อสรุป การวาดโครงสร้างของ Lewis เราสามารถระบุจำนวนคู่ของอิเล็กตรอนโดยไม่ต้องแบ่งปัน (:) บนอะตอมของ A.
เมื่อเป็นเช่นนี้บนคู่อิเล็กตรอนพวกเขาผลักอะตอมทั้งสองของ B ลงมาเปลี่ยนมุมของพวกเขา เป็นผลให้โมเลกุลเชิงเส้น B-A-B กลายเป็น V, บูมเมอแรงหรือเรขาคณิตเชิงมุม (ภาพบนสุด)
โมเลกุลของน้ำคือ H-O-H เป็นตัวอย่างที่ดีสำหรับเรขาคณิตประเภทนี้ ในอะตอมออกซิเจนมีอิเล็กตรอนสองคู่โดยไม่มีการใช้ร่วมกันซึ่งจะวางที่มุมประมาณ109º.
ทำไมมุมนี้ เนื่องจากรูปทรงอิเล็คทรอนิคส์คือ tetrahedral ซึ่งมีจุดยอดสี่จุด: สองอันสำหรับอะตอม H และอีกสองแห่งสำหรับอิเล็กตรอน ในภาพด้านบนโปรดสังเกตว่าจุดสีเขียวและ "lobes ด้วยตา" ทั้งสองวาดรูปจัตุรมุขที่มีจุดสีน้ำเงินที่ศูนย์กลาง.
ถ้า O ไม่มีคู่อิเล็กตรอนอิสระน้ำจะกลายเป็นโมเลกุลเชิงเส้นขั้วของมันจะลดลงและมหาสมุทรทะเลทะเลสาบและอื่น ๆ คงไม่มีอยู่จริง.
tetrahedral
ภาพด้านบนแสดงถึงรูปทรงเรขาคณิตแบบจัตุรมุข สำหรับโมเลกุลของน้ำนั้นรูปทรงอิเล็คทรอนิกส์ของมันคือ tetrahedral แต่โดยการกำจัดคู่ที่ปราศจากอิเล็กตรอนจะสามารถสังเกตได้ว่ามันถูกแปรสภาพเป็นเรขาคณิตเชิงมุม สิ่งนี้สามารถสังเกตได้ง่ายโดยกำจัดจุดสีเขียวสองจุด ส่วนที่เหลืออีกสองจะวาด V ด้วยจุดสีน้ำเงิน.
จะเกิดอะไรขึ้นถ้าแทนที่จะมีอิเล็กตรอนอิสระสองคู่จะมีเพียงหนึ่งเดียว? จากนั้นจะมีระนาบตรีโกณมิติ (ภาพหลัก) อย่างไรก็ตามด้วยการกำจัดกลุ่มอิเล็คทรอนิกส์ผลของสเตริคที่เกิดจากอิเล็กตรอนอิสระคู่นั้นจะไม่สามารถหลีกเลี่ยงได้ ดังนั้นมันจึงเบี่ยงเบนระนาบตรีโกณมิติกับพีระมิดฐานสามเหลี่ยม:

แม้ว่าเรขาคณิตโมเลกุลของปิรามิดแบบตรีโกณมิติและเตตราจูดจะแตกต่างกัน แต่รูปทรงทางอิเล็กทรอนิกส์ก็เหมือนกัน ปิรามิดแบบตรีโกณมิติจึงไม่นับเป็นเรขาคณิตอิเล็กทรอนิกส์?
คำตอบคือไม่เนื่องจากเป็นผลิตภัณฑ์ของการบิดเบือนที่เกิดจาก "กลีบด้วยตา" และผล steric และเรขาคณิตนี้ไม่คำนึงถึงการบิดเบือนในภายหลัง.
ด้วยเหตุนี้จึงเป็นสิ่งสำคัญเสมอที่จะต้องกำหนดเรขาคณิตอิเล็กทรอนิกส์ก่อนด้วยความช่วยเหลือของโครงสร้างของลูอิสก่อนกำหนดเรขาคณิตโมเลกุล โมเลกุลของแอมโมเนีย NH3, เป็นตัวอย่างของเรขาคณิตโมเลกุลปิรามิดแบบปิรามิด แต่ด้วยรูปทรงเรขาคณิตอิเล็คทรอนิก.
Trigonal Bipyramid
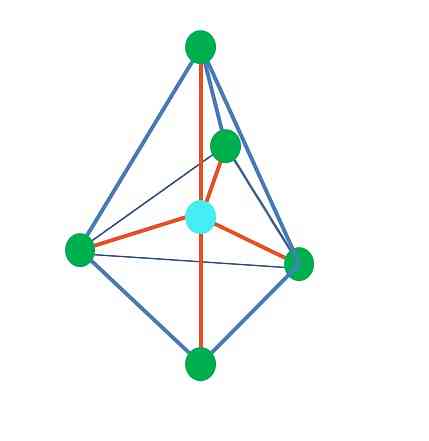
จนถึงขณะนี้ยกเว้นเรขาคณิตเชิงเส้นใน tetrahedral พีระมิดเชิงมุมและตรีโกณมิติที่อะตอมกลางมีการผสมพันธุ์ sp3, ตาม TEV ซึ่งหมายความว่าหากมุมลิงค์ของคุณได้รับการพิจารณาทดลองแล้วควรมีค่าประมาณ109º.
จากรูปทรงเรขาคณิตแบบตรีโกณมิติมีกลุ่มอิเล็กทรอนิกส์ห้ากลุ่มรอบ ๆ อะตอมกลาง ในภาพด้านบนคุณจะเห็นจุดสีเขียวห้าจุด สามในฐานสามเหลี่ยมและสองในตำแหน่งแกนซึ่งเป็นจุดยอดด้านบนและด้านล่างของปิรามิด.
จุดสีฟ้ามีการผสมแบบใด มันต้องการวงโคจรลูกผสมห้าวงเพื่อสร้างพันธะอย่างง่าย (สีส้ม) นี่คือความสำเร็จผ่านห้า sp วงโคจร3d (ผลิตภัณฑ์ที่มีส่วนผสมของวงโคจรสาม p และ a).
เมื่อพิจารณาถึงกลุ่มอิเล็กทรอนิกส์ห้ากลุ่มรูปทรงเรขาคณิตนั้นเป็นที่เปิดเผยแล้ว แต่เมื่อมีอิเล็กตรอนคู่หนึ่งโดยไม่มีการแบ่งปันกลุ่มนี้จะมีการบิดเบือนอีกครั้งที่สร้างรูปทรงเรขาคณิตอื่น นอกจากนี้คำถามต่อไปนี้เกิดขึ้น: คู่เหล่านี้สามารถครองตำแหน่งใด ๆ ในพีระมิดได้หรือไม่? เหล่านี้คือแกนหรือเส้นศูนย์สูตร.
ตำแหน่งแกนและเส้นศูนย์สูตร
จุดสีเขียวที่ประกอบเป็นฐานสามเหลี่ยมนั้นอยู่ในตำแหน่งเส้นศูนย์สูตรในขณะที่จุดทั้งสองที่ปลายบนและล่างอยู่ในตำแหน่งตามแนวแกน คู่ของอิเล็กตรอนที่ไม่มีส่วนร่วมจะอยู่ที่ไหน? ในตำแหน่งที่ช่วยลดแรงขับไฟฟ้าสถิตและผลกระทบในการฆ่าเชื้อให้เหลือน้อยที่สุด.
ในตำแหน่งแกนคู่อิเล็กตรอนจะ "กด" ตั้งฉาก (90º) บนฐานสามเหลี่ยมขณะที่อยู่ในตำแหน่งเส้นศูนย์สูตรกลุ่มอิเล็กทรอนิกส์ทั้งสองที่เหลือของฐานจะแยกจากกัน120ºและกดปลายทั้งสองที่90º สามเช่นเดียวกับฐาน).
ดังนั้นอะตอมกลางจะค้นหาทิศทางของคู่อิเล็กตรอนอิสระในตำแหน่งเส้นศูนย์สูตรเพื่อสร้างรูปทรงเรขาคณิตที่มีความเสถียรมากขึ้น.
รูปร่างสั่นและ T
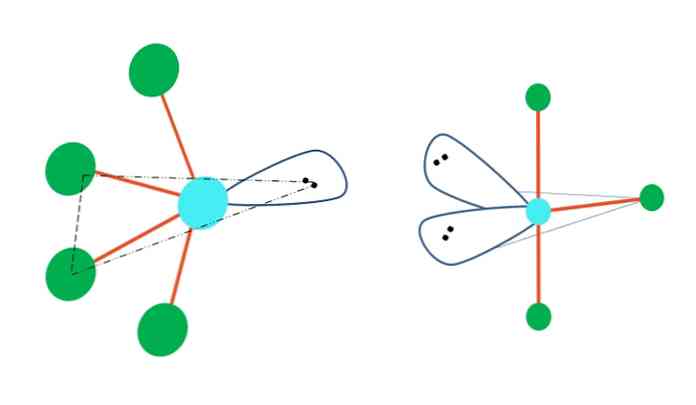
ถ้ารูปเรขาคณิตแบบตรีโกณมิติ bipyramid ต้องแทนที่อะตอมหนึ่งตัวหรือมากกว่าด้วยคู่ที่ปราศจากอิเล็กตรอนก็จะมีรูปทรงโมเลกุลที่แตกต่างกัน.
ทางด้านซ้ายของภาพด้านบนรูปทรงเรขาคณิตจะเปลี่ยนเป็นรูปแบบการสั่น ภายในอิเล็กตรอนอิสระคู่นั้นผลักอะตอมที่เหลือทั้งสี่ไปในทิศทางเดียวกันพับลิงก์ไปทางซ้าย โปรดทราบว่าคู่นี้และอะตอมสองอันอยู่ในระนาบรูปสามเหลี่ยมเดียวกันของ dipyramid ดั้งเดิม.
และทางด้านขวาของภาพคือรูปทรง T-T รูปทรงเรขาคณิตระดับโมเลกุลนี้เป็นผลมาจากการแทนที่สองอะตอมสำหรับสองคู่ของอิเล็กตรอนซึ่งเป็นผลให้อะตอมทั้งสามที่เหลืออยู่ในระนาบเดียวกัน T.
ดังนั้นสำหรับโมเลกุลประเภท AB5, มันใช้รูปทรงเรขาคณิต bipyramid ตรีโกณมิติ อย่างไรก็ตาม AB4, ด้วยรูปทรงเรขาคณิตอิเล็กทรอนิกส์เดียวกันมันจะนำรูปทรงเรขาคณิตแบบสั่น และ AB3, รูปทรงตัว T ในตัวพวกมันทั้งหมด A จะมีการผสมพันธุ์แบบ sp (โดยทั่วไป)3d.
เพื่อกำหนดรูปทรงเรขาคณิตโมเลกุลจำเป็นต้องวาดโครงสร้าง Lewis และเรขาคณิตอิเล็กทรอนิกส์ ถ้านี่คือ bipyramid แบบตรีโกณมิติแล้วคู่ที่ปราศจากอิเลคตรอนจะถูกยกเลิก แต่จะไม่ส่งผลต่อสเตียรอยด์ในส่วนที่เหลือของอะตอม ดังนั้นจึงเป็นไปได้ที่จะแยกแยะระหว่างรูปทรงโมเลกุลที่เป็นไปได้ทั้งสามอย่างสมบูรณ์แบบ.
ซึ่งมีแปดด้าน
รูปทรงเรขาคณิตโมเลกุลแปดด้านจะแสดงทางด้านขวาของภาพหลัก เรขาคณิตประเภทนี้สอดคล้องกับสารประกอบ AB6. AB4 มันสร้างฐานสี่เหลี่ยมจัตุรัสในขณะที่อีกสอง B ที่เหลืออยู่ในตำแหน่งตามแนวแกน ดังนั้นรูปสามเหลี่ยมด้านเท่าหลายรูปถูกสร้างขึ้นซึ่งเป็นใบหน้าของรูปแปดด้าน.
ที่นี่อีกครั้งอาจมี (เช่นเดียวกับในรูปทรงเรขาคณิตอิเล็กทรอนิกส์) คู่อิเล็กตรอนอิสระและดังนั้นรูปทรงเรขาคณิตโมเลกุลอื่น ๆ ที่ได้รับมาจากข้อเท็จจริงนี้ ตัวอย่างเช่น AB5 ที่มีรูปทรงเรขาคณิตอิเล็กทรอนิกส์แปดด้านประกอบด้วยปิรามิดพร้อมฐานสี่เหลี่ยมและ AB4 ของระนาบสี่เหลี่ยม:
สำหรับกรณีของรูปทรงเรขาคณิตอิเล็กทรอนิกส์แปดด้านรูปทรงเรขาคณิตของโมเลกุลทั้งสองนี้มีความเสถียรมากที่สุดในแง่ของแรงผลักไฟฟ้าสถิต ในเรขาคณิตรูปสี่เหลี่ยมจัตุรัสภาพถ่ายคู่อิเล็กตรอนทั้งสองอยู่ห่างกัน 180 °.
ไฮบริไดเซชันสำหรับอะตอม A ในรูปทรงเรขาคณิตเหล่านี้คืออะไร (หรือโครงสร้างหากเป็นเพียงโครงสร้างเดียว) อีกครั้ง TEV ยืนยันว่ามันเป็น sp3d2, วงโคจรลูกผสมหกวงซึ่งอนุญาตให้ A ปรับทิศทางกลุ่มอิเล็กทรอนิกส์ที่จุดยอดของรูปแปดด้าน.
รูปทรงโมเลกุลอื่น ๆ
ด้วยการปรับเปลี่ยนฐานของปิรามิดที่กล่าวถึงจนถึงจะสามารถหารูปทรงโมเลกุลที่ซับซ้อนมากขึ้นได้ ยกตัวอย่างเช่น bipyramid ห้าเหลี่ยมขึ้นอยู่กับเพนตากอนและสารประกอบที่ประกอบเป็นสูตรทั่วไป AB7.
เช่นเดียวกับเรขาคณิตโมเลกุลอื่น ๆ การแทนที่อะตอม B สำหรับคู่ที่ปราศจากอิเล็กตรอนจะทำให้รูปทรงเรขาคณิตบิดเบือนไปในรูปแบบอื่น.
อีกทั้งสารประกอบ AB8 พวกเขาสามารถนำรูปทรงเรขาคณิตมาใช้เช่นการต่อต้านการใช้กำลังสอง รูปทรงบางอย่างอาจมีความซับซ้อนโดยเฉพาะอย่างยิ่งสำหรับสูตร AB7 เป็นต้นไป (สูงสุดถึง AB12).
ตัวอย่าง
ถัดไปจะมีการกล่าวถึงสารประกอบต่างๆสำหรับรูปทรงเรขาคณิตของโมเลกุลหลักแต่ละอัน ในการออกกำลังกายคุณสามารถวาดโครงสร้างของลูอิสสำหรับตัวอย่างทั้งหมดและรับรองว่าถ้าด้วยรูปทรงเรขาคณิตอิเล็กทรอนิกส์คุณจะได้รูปทรงเรขาคณิตโมเลกุลตามที่ระบุไว้ด้านล่าง.
เรขาคณิตเชิงเส้น
-เอทิลีน, H2C≡CH2
-เบริลเลียมคลอไรด์ BeCl2 (CL-Be-Cl)
-ก๊าซคาร์บอนไดออกไซด์ CO2 (O = C = O)
-ไนโตรเจน2 (N≡N)
-ไดโบรไมด์ของปรอท HgBr2 (BR-HG-Br)
-ไอออนไตรโอไดด์ฉัน3- (I-I-I)
-ไฮโดรเจนไซยาไนด์, HCN (H-N≡C)
มุมของมันจะต้อง180ºและดังนั้นจึงมี sp hybridization.
เรขาคณิตเชิงมุม
-เรื่องของน้ำ
-ซัลเฟอร์ไดออกไซด์ดังนั้น2
-ไนโตรเจนไดออกไซด์, NO2
-โอโซน3
-Anion amiduro, NH2-
ระนาบตรีโกณมิติ
-โบรมีนไตรฟลูออไรด์, BF3
-ไตรคลอไรด์อลูมิเนียม AlCl3
-ไอออนไนเตรต, NO3-
-ประจุลบคาร์บอเนต CO32-
tetrahedral
-ก๊าซมีเทน CH4
-คาร์บอนเตตราคลอไรด์, CCl4
-แอมโมเนียมไอออนบวก4+
-ประจุลบซัลเฟตดังนั้น42-
พีระมิดตรีโกณมิติ
-แอมโมเนีย3
-ไอออนบวกไฮโดรเนียมไอออน3O+
Trigonal Bipyramid
-ฟอสฟอรัส pentafluoride, PF5
-พลวง Pentachloride, SbF5
ที่สั่น
ซัลเฟอร์เตตระฟลูออไรด์, SF4
รูปร่างของ T
-ไอโอดีนไตรคลอไรด์, ICl3
-คลอไรด์ไตรฟลูออไรด์, ClF3 (สารประกอบทั้งสองนี้รู้จักกันในชื่อ interhalogens)
ซึ่งมีแปดด้าน
-ซัลเฟอร์เฮกซาฟลูออไรด์, SF6
-ซีลีเนียม hexafluoride, SeF6
-Hexafluorophosphate, PF6-
ในการสรุปเรขาคณิตโมเลกุลเป็นสิ่งที่อธิบายการสังเกตของคุณสมบัติทางเคมีหรือทางกายภาพของสสาร อย่างไรก็ตามมันจะเน้นตามเรขาคณิตอิเล็กทรอนิกส์เพื่อให้หลังต้องถูกกำหนดก่อนก่อนเสมอ.
การอ้างอิง
- Whitten, Davis, Peck & Stanley เคมี (8th ed.) CENGAGE การเรียนรู้, หน้า 194-198.
- ตัวสั่นและแอตกินส์ (2008) เคมีอนินทรีย์ (ฉบับที่สี่, หน้า 23, 24, 80, 169) Mc Graw Hill.
- Mark E. Tuckerman (2011) เรขาคณิตโมเลกุลและทฤษฎี VSEPR ดึงจาก: nyu.edu
- หนังสือเคมีเสมือน Charles E. Ophardt (2003) เรขาคณิตโมเลกุลเบื้องต้น ดึงจาก: เคมี.elmhurst.edu
- เคมีเคมี (8 กันยายน 2559) เรขาคณิตของโมเลกุล ดึงมาจาก: chem.libretexts.org


