สมบัติโซเดียมไดโครเมตการผลิตอันตรายและการใช้ประโยชน์
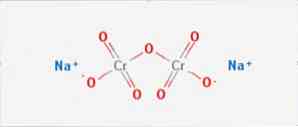
โซเดียมไดโครเมต เป็นสารประกอบอนินทรีย์ของสูตร Na2Cr2O7 มันเป็นหนึ่งในสารประกอบโครเมียมเฮกซะวาเลนท์จำนวนมาก (Cr VI) โครงสร้างของมันแสดงในรูปที่ 1 แม้ว่าโดยปกติเกลือจะถูกจัดการในรูปแบบ dihydrated ซึ่งสูตรจะเป็น Na2Cr2O7 · H2O.
มันมีพันธะไอออนิกสองตัวระหว่างโมเลกุลโซเดียมกับ oxygens ที่มีประจุลบ แร่โครเมียมสกัดจากโซเดียมไดโครเมต ผลิตโซเดียมไดโครเมตหลายล้านกิโลกรัมต่อปี.
ประเทศจีนเป็นผู้ผลิตโซเดียมไดโครเมตที่ใหญ่ที่สุด แต่โรงงานเคมีของจีนมีการผลิตค่อนข้างต่ำน้อยกว่าปีละ 50,000 ตันต่อปีเมื่อเปรียบเทียบกับโรงงานคาซัคสถานที่ผลิตได้มากกว่า 100,000 ตันต่อปี.
พืชในรัสเซียสหรัฐอเมริกาและสหราชอาณาจักรมีการผลิตขั้นกลางระหว่าง 50,000 ถึง 100,000 ตันต่อปี (Kogel, 2006).
ในแง่ของปฏิกิริยาและรูปลักษณ์โซเดียมไดโครเมตมีคุณสมบัติคล้ายกับโพแทสเซียมไดโครเมตอย่างไรก็ตามเกลือโซเดียมนั้นละลายในน้ำได้มากกว่าและมีน้ำหนักน้อยกว่าเกลือโพแทสเซียม.
โซเดียมไดโครเมตก่อให้เกิดไอระเหยของโครเมียมพิษเมื่อถูกความร้อน เป็นสารออกซิไดซ์ที่แรงและมีฤทธิ์กัดกร่อนสูง.
สารประกอบนี้สามารถพบได้ในแหล่งน้ำดื่มที่ปนเปื้อนด้วยกระบวนการทางอุตสาหกรรมที่แตกต่างกันเช่นเทคนิคการชุบสังกะสีหรือชุบด้วยไฟฟ้าการฟอกหนังหนังและการผลิตสิ่งทอ.
ดัชนี
- 1 คุณสมบัติทางกายภาพและทางเคมี
- 2 วิธีการผลิต
- 3 ปฏิกิริยาและอันตราย
- 4 การใช้และแอปพลิเคชัน
- 5 ชีวเคมี
- 6 อ้างอิง
คุณสมบัติทางกายภาพและทางเคมี
โซเดียมไดโครเมประกอบด้วยผลึกที่มีโครงสร้าง monoclinic สีส้มสีแดงในรูปแบบของพวกเขาปราศจากและไม่มีกลิ่น น้ำหนักโมเลกุลของมันคือ 261.97 g / mol ในรูปแบบ anhydrous และ 298.00 g / mol ในรูป dihydrated.
มีจุดหลอมเหลว 356.7 องศาเซลเซียสจุดเดือด 400 องศาเซลเซียสที่มันสลายตัว มีความหนาแน่น 2.52 g / ml.

รูปที่ 2 แสดงลักษณะของโซเดียมไดโครเมต ความสามารถในการละลายของน้ำอยู่ที่ 187 กรัมต่อ 100 กรัมที่ 25 องศาเซลเซียสและความสามารถในการละลายของเอธานอลอยู่ที่ 513.2 กรัมต่อลิตรที่ 19.4 องศาเซลเซียส (ศูนย์ข้อมูลเทคโนโลยีชีวภาพแห่งชาติ, s.f. ).
ถือว่าเป็นสารประกอบที่มีความเสถียรหากจัดเก็บภายใต้เงื่อนไขที่แนะนำและไม่ติดไฟ เนื่องจากเป็นสารออกซิไดซ์ที่แรงจึงมีฤทธิ์กัดกร่อนและในสารละลายเป็นกรดที่มีความสามารถในการลดค่า pH ให้เหลือ 4 ในสารละลายที่มี 1% w / v.
วิธีการผลิต
โซเดียมโครเมตสามารถแปลงเป็นไดโครเมตโดยกระบวนการต่อเนื่องที่ปฏิบัติกับกรดซัลฟิวริกคาร์บอนไดออกไซด์หรือการรวมกันของทั้งสอง.
การระเหยของสุราโซเดียมไดโครเมตทำให้เกิดการตกตะกอนของโซเดียมซัลเฟตและ / หรือโซเดียมไบคาร์บอเนตและสารประกอบเหล่านี้จะถูกกำจัดออกก่อนการตกผลึกสุดท้ายของโซเดียมไดโครเม.
โซเดียมไดโครเมตสามารถทำได้ในกระบวนการสามขั้นตอน:
- การคั่วอัลคาไลน์ของสภาวะออกซิเดชันของโครไมต์
- การรั่วไหล การสกัดสารที่ละลายได้จากส่วนผสมโดยการกระทำของตัวทำละลายของเหลว
- การเปลี่ยนโซเดียมโมโนโครมในโซเดียมไดโครเมตโดยใช้กรด.
โซเดียมไดคลอโรเนตสามารถเตรียมได้โดยการละลายโซเดียมไดไฮเดรตไดไฮเดรต, การตกผลึกสารละลายไดคลอโรเตตที่มีอุณหภูมิสูงกว่า 86 องศาเซลเซียสหรือการแก้ปัญหาโซเดียมไดโครเมตในเครื่องอบแห้งแบบสเปรย์.
สารละลายโซเดียมไดโครเมตที่ 69 และ 70% โดยน้ำหนักเป็นวิธีการที่สะดวกและประหยัดค่าใช้จ่ายในการส่งปริมาณหลีกเลี่ยงความจำเป็นในการจัดการด้วยตนเองหรือการสลายผลึก.
ปฏิกิริยาและอันตราย
เป็นสารออกซิไดซ์ที่แรง เข้ากันไม่ได้กับกรดแก่ การสัมผัสกับสารซึ่งไหม้ไฟได้อาจทำให้เกิดไฟไหม้ ไอระเหยที่เป็นพิษของโครเมียมออกไซด์สามารถเกิดขึ้นได้ในที่ที่มีความร้อนหรือไฟไหม้.
ที่รู้จักกันในชื่อ "ส่วนผสมกรด chromic" ของไดโครเมตและกรดซัลฟิวริกกับสารอินทรีย์ทำให้เกิดปฏิกิริยาคายความร้อนอย่างรุนแรง ส่วนผสมนี้ร่วมกับอะซิโตนตกค้างยังนำไปสู่ปฏิกิริยารุนแรง.
การรวมกันของไดโครเมตและกรดซัลฟูริกกับแอลกอฮอล์เอทานอลและ 2 โพรพานอลทำให้เกิดปฏิกิริยาคายความร้อนอย่างรุนแรง เนื่องจากการเกิดขึ้นของหลายเหตุการณ์ที่เกี่ยวข้องกับการผสมของกรดไดโครเมต - ซัลเฟอร์กับสารอินทรีย์ที่สามารถออกซิไดซ์ได้มันอาจจะดีที่สุดที่จะหลีกเลี่ยงการมีปฏิสัมพันธ์ดังกล่าว.
การรวมกันของไดโครเมตกับไฮดราซีนนั้นจะเกิดการระเบิดปฏิกิริยาของไดโครเมตนั้นคาดว่าจะรุนแรงกับเอมีนโดยทั่วไป การเติมเกลือไดคลอโรเตตแบบแห้งลงในอะซิติกแอนไฮไดด์ทำให้เกิดปฏิกิริยาคายความร้อนที่ระเบิดได้ในที่สุด.
โบรอนซิลิกอนและไดโครเมตก่อตัวเป็นส่วนผสมของพลุไฟ ส่วนผสมของกรดอะซิติก 2-methyl-2-pentenal และ dichromate นำไปสู่ปฏิกิริยาอาละวาด (แผ่นข้อมูลทางเคมี Sodium Dichromate, 2016).
การสูดดมฝุ่นหรือละอองทำให้เกิดอาการระคายเคืองต่อระบบทางเดินหายใจซึ่งบางครั้งก็คล้ายกับโรคหอบหืด อาจเกิดการเจาะทะลุ ถือว่าเป็นพิษ.
การกลืนกินทำให้เกิดการอาเจียนท้องเสียและผิดปกติอย่างมากจากภาวะแทรกซ้อนของกระเพาะอาหารและไต การสัมผัสดวงตาหรือผิวหนังทำให้เกิดการระคายเคืองในท้องถิ่น การสัมผัสกับผิวหนังหลายครั้งทำให้เกิดโรคผิวหนัง.
โซเดียมไดโครเมตเป็นสารก่อมะเร็งในมนุษย์ มีหลักฐานว่าสารประกอบโครเมียมเฮกซะวาเลนท์หรือ Cr (VI) สามารถก่อให้เกิดมะเร็งปอดในมนุษย์ มันแสดงให้เห็นว่าโซเดียมไดโครเมตเป็นสาเหตุของโรคมะเร็งปอดในสัตว์.
แม้ว่าโซเดียมไดโครเมตไม่ได้ถูกระบุว่าเป็นสารก่อวิรูปหรือความเสี่ยงต่อการสืบพันธุ์ แต่ก็เป็นที่ทราบกันว่าสารประกอบโครเมียมเฮกซะวาเลนท์หรือ Cr (VI) เป็นตัวทำให้ทารกพิการและทำให้เกิดความเสียหายต่อระบบสืบพันธุ์เช่นการลดภาวะเจริญพันธุ์.
โซเดียมไดโครเมตสามารถทำให้ตับและไตถูกทำลายได้ดังนั้นจึงต้องมีการจัดการอย่างระมัดระวัง (กรมอนามัยนิวเจอร์ซีย์, 2009).
ในกรณีที่กลืนกินผู้ป่วยควรดื่มน้ำหรือนม อย่าทำให้อาเจียน ในกรณีที่สัมผัสกับผิวหนังหรือดวงตาก็ควรได้รับการปฏิบัติเหมือนกรดไหม้; ชะล้างดวงตาด้วยน้ำอย่างน้อย 15 นาที.
แผลภายนอกสามารถถูด้วยสารละลายโซเดียมไธโอซัลเฟต 2% ในทุกกรณีควรปรึกษาแพทย์.
การใช้งานและการใช้งาน
นอกเหนือจากความสำคัญในการผลิตสารเคมีโครเมี่ยมอื่น ๆ แล้วโซเดียมไดโครเมตยังมีการใช้โดยตรงหลายอย่างเป็นส่วนผสมในการผลิต:
- พื้นผิวโลหะ: ช่วยต้านทานการกัดกร่อนและทำความสะอาดพื้นผิวโลหะและยังช่วยยึดเกาะกับสี.
- ผลิตภัณฑ์ออร์แกนิก: ใช้เป็นสารออกซิไดซ์ในการผลิตผลิตภัณฑ์เช่นวิตามินเคและขี้ผึ้ง.
- รงควัตถุ: ใช้ในการผลิตเม็ดสีอนินทรีย์โครเมตซึ่งทำให้สีมีความคงตัวต่อแสง โครเมตบางเกรดยังใช้เป็นสารยับยั้งการกัดกร่อนในชั้นล่างและไพรเมอร์.
- เซรามิค: ใช้ในการจัดทำแว่นตาสีและเคลือบเซรามิก.
- สิ่งทอ: ใช้เป็น mordant สำหรับสีย้อมที่เป็นกรดเพื่อปรับปรุงคุณสมบัติการย้อมสีอย่างรวดเร็ว.
- ผลิตโครเมียมซัลเฟต.
(โซเดียมไดโครเมต, บล็อคอาคารสำหรับสารประกอบโครเมียมอื่น ๆ แทบทั้งหมด, 2010-2012)
Sodium dichromate Dihydrate การใช้งานเหมาะอย่างยิ่งในสภาวะต่าง ๆ รวมถึงการใช้งานที่อุณหภูมิสูงเช่นเซรามิกเคลือบและกระจกสี.
Chromic ออกไซด์แข็งกว่าโลหะออกไซด์อื่น ๆ เช่นไทเทเนียมหรือเหล็กเหมาะสำหรับสภาพแวดล้อมที่อุณหภูมิและกระบวนการในการผลิตมีความก้าวร้าว.
สารนี้ส่วนใหญ่จะใช้ในการผลิตสารประกอบโครเมียมอื่น ๆ แต่ก็ยังใช้ในโคลนเบนโทไนท์ที่ใช้ในการผลิตน้ำมันในสารกันบูดไม้ในการผลิตสารอินทรีย์และเป็นสารยับยั้งการกัดกร่อน.
เมื่อผสมกับอลูมิเนียมและโพแทสเซียมไดโครเมตโดยใช้กระบวนการความร้อนอะลูมิโนโครมิกออกไซด์จะผลิตโครเมียมโลหะที่มีความบริสุทธิ์สูง นี่เป็นส่วนผสมที่สำคัญในการผลิตซูเปอร์อัลลอยประสิทธิภาพสูงที่ใช้ในอุตสาหกรรมการบินและอวกาศ.
ในการสังเคราะห์สารอินทรีย์โซเดียมไดโครเมตใช้เป็นตัวออกซิไดซ์ในปฏิกิริยาการลดออกไซด์เมื่อมีกรดซัลฟูริก.
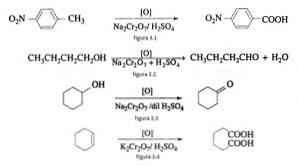
ยกตัวอย่างเช่นการเกิดออกซิเดชันของ p-nitrotoluene เพื่อสร้างกรด p-nitrobenzoic ในการเกิดออกซิเดชันของ n-butanol เพื่อสร้าง n-butaldehyde ในการสร้าง cyclohexanone จาก cyclohexanol และการก่อตัวของกรด adipic ดังแสดงในรูปที่ 3.1 , 3.2, 3.3 และ 3.4 ตามลำดับ (VK Ahluwalia, 2004).
ชีวเคมี
Intratracheal instillation ของโซเดียมไดโครเมต (CrVI) และโครเมียมอะซิเตตไฮดรอกไซด์ (CrIII) ในหนูตัวผู้ส่งผลให้ความเข้มข้นของโครเมียมเพิ่มขึ้นในเลือดทั้งหมดพลาสมาและปัสสาวะสูงถึง 72 ชั่วโมงหลังจากได้รับ; ความเข้มข้นสูงสุดถึง 6 ชั่วโมงหลังจากได้รับ.
อัตราส่วนระหว่างโครเมียมในเลือดทั้งหมดและความเข้มข้นของโครเมียมในพลาสมาแตกต่างกันอย่างมีนัยสำคัญสำหรับการรักษา Cr (VI) และ Cr (III) ดังนั้นจึงควรใช้การวิเคราะห์โครเมียมในเลือดและโครเมียมในพลาสมาเพื่อประเมินการได้รับโครเมี่ยม.
ตรวจพบโครเมียมในเซลล์เม็ดเลือดขาวต่อพ่วง Cr (VI) แต่ไม่ใช่ Cr (III) สะสมอย่างมีนัยสำคัญในเซลล์เม็ดเลือดขาวหลังการรักษา เซลล์เหล่านี้มีศักยภาพที่จะใช้เป็นไบโอมาร์คเกอร์ในการประเมินการสัมผัสกับสารประกอบโครเมียม (Hooth, 2008).
การอ้างอิง
- เอกสารข้อมูลทางเคมีโซเดียมไดโครเมต (2016) ดึงมาจากสารเคมีของจี้: cameochemicals.noaa.
- Hooth, M. J. (2008) รายงานทางเทคนิคเกี่ยวกับพิษวิทยาและการศึกษาการก่อมะเร็งของโซเดียมไดโครเม สถาบันสุขภาพแห่งชาติสหรัฐอเมริกา.
- Kogel, J. E. (2006) แร่และหินอุตสาหกรรม: สินค้าตลาดและการใช้ฉบับที่เจ็ด Littleton Colorado: สังคมแห่งการทำเหมือง metallurgyc และการสำรวจ inc.
- ศูนย์ข้อมูลเทคโนโลยีชีวภาพแห่งชาติ. ( N.d. ) PubChem ฐานข้อมูลแบบผสม; CID = 25408 สืบค้นจาก pubchem.com: pubchem.ncbi.nlm.nih.gov.
- กรมอนามัยนิวเจอร์ซีย์ (2009, พฤศจิกายน) ความเป็นจริงของสารที่เป็นอันตรายแผ่นโซเดียมไดโครเมต สืบค้นจาก nj.gov: nj.gov.
- โซเดียมไดโครเมต Building Block สำหรับสารประกอบโครเมียมอื่น ๆ (2010-2012) ดึงมาจาก elementis chromium: elementischromium.com
- K. Ahluwalia, R. A. (2004) เคมีอินทรีย์เชิงปฏิบัติที่ครอบคลุม: การเตรียมและการวิเคราะห์เชิงปริมาณ นิวเดลี: สำนักพิมพ์มหาวิทยาลัย (อินเดีย).


