สูตรกรดโพรพานิกคุณสมบัติความเสี่ยงและการใช้ประโยชน์
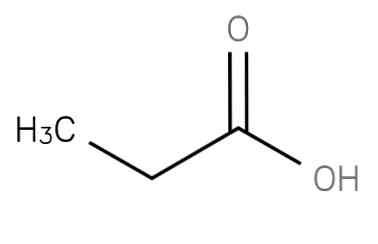
กรดโพรพนิก เป็นกรดไขมันสายสั้นอิ่มตัวซึ่งประกอบด้วยอีเทนที่จับกับคาร์บอนของกลุ่มคาร์บอกซี สูตรของมันคือ CH3-CH2-COOH. ประจุลบ CH3CH2COO- เช่นเดียวกับเกลือและเอสเทอร์ของกรดโพรเพนเป็นที่รู้จักกันในชื่อ propionates (หรือ propanoates).
สามารถได้มาจากเยื่อไม้เหลือทิ้งโดยกระบวนการหมักโดยใช้แบคทีเรียในสกุล Propionibacterium. มันยังได้มาจากเอทานอลและคาร์บอนมอนอกไซด์โดยใช้ตัวเร่งปฏิกิริยาโบรอนไตรฟลูออไรด์ (O'Neil, 2001).
อีกวิธีในการรับกรดโพรพานิคคือการเกิดออกซิเดชันของโพรพิโอชันดีไฮด์ต่อหน้าโคบอลต์หรือแมงกานีสไอออน ปฏิกิริยานี้พัฒนาอย่างรวดเร็วที่อุณหภูมิต่ำถึง 40-50 ° C:
2CH3CH2CHO + O2 → 2CH3CH2COOH
สารประกอบนี้มีอยู่ในระดับต่ำในผลิตภัณฑ์นมและผลิตในรูปแบบทั่วไปพร้อมกับกรดไขมันสายสั้นอื่น ๆ ในทางเดินอาหารของมนุษย์และสัตว์เลี้ยงลูกด้วยนมอื่น ๆ ซึ่งเป็นผลิตภัณฑ์ขั้นสุดท้ายของการย่อยจุลินทรีย์ของคาร์โบไฮเดรต.
มีกิจกรรมทางสรีรวิทยาที่สำคัญในสัตว์ (ฐานข้อมูลมนุษย์ Metabolome, 2017).
ดัชนี
- 1 คุณสมบัติทางกายภาพและทางเคมี
- 2 ปฏิกิริยาและอันตราย
- 3 ชีวเคมี
- 4 ใช้
- 5 อ้างอิง
คุณสมบัติทางกายภาพและทางเคมี
กรดโพรพนิคเป็นของเหลวที่ไม่มีสีและมันมีกลิ่นฉุนไม่เป็นที่พอใจและหืน ลักษณะที่ปรากฏอยู่ในรูปที่ 2 (ศูนย์ข้อมูลเทคโนโลยีชีวภาพแห่งชาติ 2017).

กรดโพรพนิคมีน้ำหนักโมเลกุล 74.08 กรัมต่อโมลและมีความหนาแน่น 0.992 กรัมต่อมิลลิลิตร มีจุดเยือกแข็งและจุดเดือด -20.5 ° C และ 141.1 ° C ตามลำดับ โพรเพนกรดเป็นกรดอ่อนที่ pKa คือ 4.88.
สารประกอบนี้ละลายได้ในน้ำสามารถละลายสารประกอบ 34.97 กรัมต่อตัวทำละลาย 100 มล. ละลายได้ในเอทานอลอีเธอร์และคลอโรฟอร์ม (ราชสมาคมเคมีปี 2558).
กรดโพรพนิกมีคุณสมบัติทางกายภาพปานกลางระหว่างกรดคาร์บอกซิลิกขนาดเล็กกรดฟอร์มิกและกรดอะซิติกและกรดไขมันขนาดใหญ่.
มันแสดงให้เห็นคุณสมบัติทั่วไปของกรดคาร์บอกซิลิกและสามารถสร้างเอไมด์, เอสเตอร์, แอนไฮไดรด์และอนุพันธ์คลอไรด์ สามารถรับอัลฟาฮาโลเจนเนตินกับโบรมีนต่อหน้า PBr3 เป็นตัวเร่งปฏิกิริยา (ปฏิกิริยา HVZ) เพื่อสร้าง CH3CHBrCOOH.
ปฏิกิริยาและอันตราย
กรดโพรพนิกเป็นวัสดุไวไฟและติดไฟได้ สามารถติดไฟได้โดยความร้อนประกายไฟหรือเปลวไฟ ไอสามารถก่อตัวเป็นส่วนผสมที่ระเบิดได้กับอากาศสามารถเดินทางไปยังแหล่งกำเนิดประกายไฟและระเบิดได้.
ไอส่วนใหญ่หนักกว่าอากาศ พวกมันจะกระจายไปตามพื้นดินและจะถูกรวบรวมในพื้นที่ต่ำหรือพื้นที่ จำกัด (ท่อระบายน้ำ, ชั้นใต้ดิน, ถัง) อันตรายจากการระเบิดของไอน้ำในอาคาร, กลางแจ้งหรือในท่อระบายน้ำ.
สารที่กำหนดด้วย (P) สามารถเกิดปฏิกิริยาพอลิเมอร์ระเบิดได้เมื่อถูกความร้อนหรือห่อด้วยไฟ ภาชนะบรรจุสามารถระเบิดได้เมื่อถูกความร้อน (PROPIONIC ACID, 2016).
สารประกอบควรเก็บให้ห่างจากความร้อนหรือแหล่งกำเนิดประกายไฟ เมื่อถูกความร้อนจนถึงการสลายตัวจะปล่อยควันฉุนและควันที่ระคายเคืองออกมา.
กรดโพรปานิคระคายเคืองต่อผิวหนัง, ตา, จมูกและลำคอ แต่ไม่ก่อให้เกิดผลกระทบต่อระบบอย่างเฉียบพลันและไม่มีศักยภาพในการเกิดจีโนมพิษ ในกรณีที่สัมผัสกับสารควรล้างด้วยน้ำปริมาณมาก (เอกสารข้อมูลความปลอดภัยของสารโพรพิโอนิคกรด, 2013).
ชีวเคมี
ฐาน conjugate ของกรดโพรพานิ, propionate, เกิดขึ้นเป็นชิ้นส่วนขั้วของสามคาร์บอน (เปิดใช้งานด้วยโคเอนไซม์ A เป็น propionyl-CoA) ในการเกิดออกซิเดชันของกรดไขมันคาร์บอนเลขคี่และออกซิเดชันของโซ่ด้านข้าง คอเลสเตอรอล.
การทดลองกับไอโซโทปกัมมันตรังสีของโพรพีเนตที่ฉีดในหนูอดอาหารบ่งชี้ว่าสามารถปรากฏในไกลโคเจนกลูโคสตัวกลางของวงจรกรดซิตริกกรดอะมิโนและโปรตีน.
เส้นทางของการเผาผลาญกรดโพรพนิกเกี่ยวข้องกับการทำงานร่วมกับโคเอ็นไซม์เอ, คาร์บอกซิเลชั่นในรูปแบบเมธิลมาโลนิล - โคเอนไซม์, และการเปลี่ยนเป็นกรดซัคซินิค, ซึ่งเข้าสู่วงจรกรดซิตริก.
กรดโพรเพนสามารถออกซิไดซ์ได้โดยไม่ต้องสร้างคีโตนและในทางตรงกันข้ามกับกรดอะซิติกจะถูกรวมเข้าไปในคาร์โบไฮเดรตและไขมัน (Bingham, Cohrssen, & Powell, 2001).
Propionic aciduria เป็นหนึ่งใน acidurias อินทรีย์ที่พบบ่อยที่สุดซึ่งเป็นโรคที่ประกอบด้วยความผิดปกติหลายอย่าง.
ผลลัพธ์ของผู้ป่วยที่เกิดจากโพรพิโอนิค aciduria นั้นแย่ในรูปแบบของการพัฒนาทางปัญญาโดย 60% ที่มี IQ น้อยกว่า 75 และต้องมีการศึกษาพิเศษ.
การปลูกถ่ายตับและ / หรือไตที่ประสบความสำเร็จในผู้ป่วยเพียงไม่กี่คนทำให้คุณภาพชีวิตดีขึ้น แต่ไม่จำเป็นต้องป้องกันภาวะแทรกซ้อนทางระบบประสาทและอวัยวะภายใน.
ผลลัพธ์เหล่านี้เน้นถึงความต้องการการติดตามการเผาผลาญอย่างถาวรโดยไม่ขึ้นอยู่กับกลยุทธ์การรักษา.
การใช้งาน
กรดโพรเพนยับยั้งการเจริญเติบโตของแบคทีเรียและเชื้อราในระดับระหว่าง 0.1 ถึง 1% โดยน้ำหนัก เป็นผลให้โพรเพนกรดที่ผลิตส่วนใหญ่ใช้เป็นสารกันบูดสำหรับอาหารและอาหารสำหรับมนุษย์บริโภคเช่นธัญพืชและธัญพืช.
การอนุรักษ์อาหารธัญพืชและอาหารเช่นเดียวกับการผลิตแคลเซียมและโซเดียมโพรไพเนตที่แสดงถึงเกือบ 80% ของการบริโภคกรดโพรเพนในโลกในปี 2559 เทียบกับ 78.5% ในปี 2555.
ประมาณ 51% ของการบริโภคกรดโพรพานิกในโลกนั้นใช้สำหรับอาหารสัตว์และการถนอมเมล็ดข้าวในขณะที่เกือบ 29% จะใช้ในการผลิตแคลเซียมและโซเดียมโพรพโอเนตที่ใช้ในอุตสาหกรรมอาหารและอาหารสัตว์.
ตลาดที่สำคัญอื่น ๆ สำหรับโพรเพนกรดคือการผลิตสารกำจัดวัชพืชและไดเอทิลคีโตน ปริมาณการใช้งานที่ลดลง ได้แก่ เซลลูโลสอะซิเตตโพรพิโอเนต, ยา, เอสเทอร์ตัวทำละลาย, รสและน้ำหอม, พลาสติไซเซอร์, สีย้อมและสิ่งทอเสริม.
ความต้องการกรดโพรเพนนั้นขึ้นอยู่กับการผลิตอาหารสัตว์และธัญพืชเป็นหลักรองลงมาคืออาหารสำเร็จรูปและผลิตภัณฑ์เบเกอรี่.
โอกาสในการเติบโตของกรดโพรพานิกทั่วโลกและเกลือในอาหารสัตว์ / ธัญพืชและการถนอมอาหารมีความสำคัญ (IHS Markit, 2016).
ตลาดที่เติบโตอย่างรวดเร็วอื่น ๆ ได้แก่ propionate esters สำหรับตัวทำละลายเช่น n-butyl propionate และ pentyl; เอสเทอร์เหล่านี้ถูกใช้มากขึ้นเพื่อทดแทนตัวทำละลายที่ระบุว่าเป็นมลพิษทางอากาศที่เป็นอันตราย.
การอ้างอิง
- Bingham, E. , Cohrssen, B. , & Powell, C. (2001) พิษวิทยาของ Patty เล่ม 1-9 5th ed. นิวยอร์ก: John Wiley & Sons.
- EMBL-EBI (2016, 14 ตุลาคม) กรดโพรพิโอนิค กู้คืนจาก ChEBI: ebi.ac.uk.
- ฐานข้อมูลเมตาโบโลเมของมนุษย์ (2017, 2 มีนาคม) กรดโพรพิโอนิค ดึงมาจาก hmdb.ca: hmdb.ca.
- IHS Markit (2016, ธันวาคม) คู่มือเคมีทางเศรษฐศาสตร์ของกรดโพรพิโอนิค. สืบค้นจาก ihs: ihs.com.
- เอกสารข้อมูลความปลอดภัยของวัสดุกรดโพรพิโอนิก (2013, 21 พฤษภาคม) สืบค้นจาก sciencelab: sciencelab.com.
- ศูนย์ข้อมูลเทคโนโลยีชีวภาพแห่งชาติ ... (2017, 22 เมษายน) PubChem ฐานข้อมูลแบบผสม; CID = 1032 สืบค้นจาก pubchem.ncbi.nlm.nih.gov.
- O'Neil, M. (. (2001), The Merck Index - สารานุกรมของสารเคมี, ยาเสพติด, และชีววิทยารุ่นที่ 13, นิวเจอร์ซีย์: Merck and Co. , Inc..
- กรดโพรพิโอนิค (2016) สืบค้นจาก cameochemicals: cameochemicals.noaa.gov.
- ราชสมาคมเคมี (2015) กรดโพรพิโอนิค สืบค้นจาก chemspider: chemspider.com.


