ลักษณะของเชื้อ Vibrio cholerae อนุกรมวิธานสัณฐานวิทยาถิ่นที่อยู่
Vibrio cholerae เป็นแบคทีเรียแกรมลบแบบไม่ใช้ออกซิเจน สายพันธุ์เป็นสาเหตุของโรคอหิวาตกโรคในมนุษย์ โรคลำไส้นี้ทำให้เกิดอาการท้องเสียอย่างรุนแรงและอาจทำให้เสียชีวิตหากไม่ได้รับการรักษาอย่างเพียงพอ ทำให้มีผู้เสียชีวิตมากกว่า 100,000 คนต่อปีส่วนใหญ่เป็นเด็ก.
อหิวาตกโรคส่งผ่านทางน้ำและอาหารที่มีการปนเปื้อนหรือจากการสัมผัสระหว่างบุคคลต่อบุคคล การรักษารวมถึงการรักษาด้วยการคืนและยาปฏิชีวนะที่เฉพาะเจาะจง มีวัคซีนบริหารช่องปากของความสำเร็จของญาติ.
ดัชนี
- 1 ลักษณะทั่วไป
- 2 Phylogeny และอนุกรมวิธาน
- 3 สัณฐานวิทยา
- 4 Habitat
- 5 การสืบพันธุ์และวงจรชีวิต
- 6 โภชนาการ
- 7 การเกิดโรค
- 7.1 การส่งกำลัง
- 7.2 ระบาดวิทยา
- 7.3 รูปแบบของการกระทำ
- 8 อาการและการรักษา
- 9 อ้างอิง
ลักษณะทั่วไป
Vibrio cholerae มันเป็นสิ่งมีชีวิตเซลล์เดียวที่มีผนังเซลล์ ผนังเซลล์นั้นบางประกอบด้วย peptidoglycan ระหว่างสองแผ่นฟอสโฟลิปิด มันอาศัยอยู่ในสภาพแวดล้อมทางน้ำโดยเฉพาะบริเวณปากแม่น้ำและบ่อที่เกี่ยวข้องกับแพลงก์ตอนสาหร่ายและสัตว์ มีการรู้จักสองสายพันธุ์และหลายสายพันธุ์.
ไบโอฟิล์ม
แบคทีเรียเป็นส่วนหนึ่งของ bacterioplankton ในแหล่งน้ำทั้งในรูปแบบอิสระ (vibrios) และสร้างแผ่นฟิล์มบาง ๆ (biofilms) บนพื้นผิวอินทรีย์.
แผ่นชีวะเหล่านี้ประกอบด้วยกลุ่มแบคทีเรียที่ล้อมรอบด้วยช่องน้ำ การยึดเกาะของฟิล์มชีวภาพเป็นไปได้ด้วยการผลิตโพลีแซคคาไรด์จากเยื่อหุ้มชั้นนอก.
ยีน
Vibrio cholerae มันมีสองโครโมโซมในรูปแบบของพลาสมิด เผ่าพันธุ์ที่ทำให้เกิดโรคมียีนที่รหัสสำหรับการผลิตของอหิวาตกโรคสารพิษ (CT สำหรับตัวย่อในภาษาอังกฤษ).
นอกจากนี้ยังมียีนสำหรับปัจจัยการตั้งอาณานิคม Pilus ได้รับการควบคุมโดยพิษ (TCP) และโปรตีนควบคุม (ToxR) โปรตีนนี้ควบคุมการแสดงออกของ CT และ TCP ส่วนหนึ่งของข้อมูลทางพันธุกรรมที่เป็นรหัสสำหรับปัจจัยการก่อโรคเหล่านี้จัดทำโดย bacteriophages.
จีโนม
จีโนมของมันประกอบด้วย 4.03 Mb กระจายในสองโครโมโซมขนาดไม่เท่ากัน ลำดับ DNA ของจีโนมทั้งหมดของสายพันธุ์ N16961 ของ V. cholerae O1.
ลำดับที่จัดอยู่ในโครโมโซม 1 ดูเหมือนจะรับผิดชอบกระบวนการต่าง ๆ กลุ่มคนเหล่านี้การคูณดีเอ็นเอการแบ่งเซลล์การถอดรหัสยีนการแปลโปรตีนและการสังเคราะห์ผนังเซลล์.
บนโครโมโซม 2 โปรตีนไรโบโซมจะถูกสังเคราะห์ซึ่งมีหน้าที่ในการขนส่งน้ำตาลไอออนและแอนไอออนการเผาผลาญน้ำตาลและซ่อมแซมดีเอ็นเอ.
ภายในแบคทีเรียนี้มีการตรวจพบ bacteriophages หรือ phages ใยอย่างน้อยเจ็ดตัว Phages เป็นไวรัสพยาธิของแบคทีเรีย phage CTX เป็นส่วนหนึ่งของลำดับที่เข้ารหัสการสังเคราะห์อหิวาตกโรค (CT) นี่คือสาเหตุที่การแปลง lysogenic,
ในระยะสั้นการเกิดโรคของสายพันธุ์บางอย่าง Vibrio cholerae มันขึ้นอยู่กับระบบพันธุกรรมที่ซับซ้อนของปัจจัยที่ทำให้เกิดโรค ในหมู่พวกเขาปัจจัยของการล่าอาณานิคม pilus ร่วมควบคุมโดย toxin (TCP) และโปรตีนควบคุม (ToxR) ที่ร่วมควบคุมการแสดงออกของ CT และ TCP.
การแพร่กระจาย
เมื่อมนุษย์บริโภคอาหารหรือน้ำที่มีการปนเปื้อนแบคทีเรียจะเข้าสู่ระบบย่อยอาหารของเขา เมื่อมันไปถึงลำไส้เล็กมันจะยึดเกาะกับเยื่อบุผิว.
มันจะหลั่งสารพิษที่ก่อให้เกิดกระบวนการทางชีวเคมีที่ทำให้เกิดอาการท้องร่วง ในสภาพแวดล้อมเช่นนี้แบคทีเรียจะบำรุงเลี้ยงและสืบพันธุ์โดยปล่อยออกมาอีกครั้งผ่านทางอุจจาระ การสืบพันธุ์ของมันคือโดยสองฝ่าย.
สายเลือดและอนุกรมวิธาน
เรื่องเพศ วิบริโอ รวมกว่า 100 ชนิดที่อธิบายไว้ ในจำนวนนี้มี 12 สาเหตุที่ทำให้เกิดโรคในมนุษย์ อยู่ในโดเมน Bacteria, phylum Proteobacteria (กลุ่มแกมม่า), สั่งการ Vibrionales, ครอบครัว Vibrionaceae.
Vibrio cholerae มันเป็นสายพันธุ์ที่กำหนดไว้อย่างดีโดยการทดสอบทางชีวเคมีและ DNA ทดสอบค่าบวกสำหรับ catalase และ oxidase และมันไม่หมักแลคโตส.
Filippo Pacini แพทย์ชาวอิตาลีเป็นคนแรกที่แยกแบคทีเรียอหิวาตกโรคในปี 1854 Pacini ให้ชื่อวิทยาศาสตร์และระบุว่ามันเป็นตัวแทนสาเหตุของโรค.
มากกว่า 200 กลุ่มของ Vibrio cholerae, แต่จนถึงปัจจุบันมีเพียง 01 และ 0139 เท่านั้นที่เป็นพิษ แต่ละกลุ่ม serogroup สามารถแบ่งออกเป็นรูปแบบแอนติเจนหรือ serotypes ที่แตกต่างกัน กลุ่มคนเหล่านี้คือ Ogawa และ Inaba หรือสิ่งมีชีวิตที่แตกต่างกันเช่นแบบดั้งเดิมและแบบ Tor.
ลักษณะทางสัณฐานวิทยา
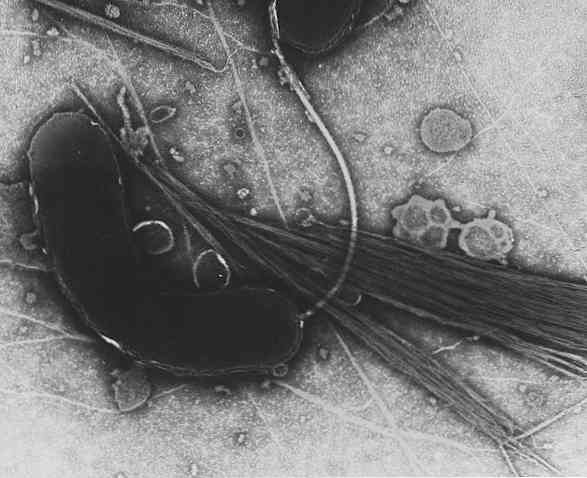
Vibrio cholerae มันเป็นบาซิลลัส (แบคทีเรียรูปแท่งหรือแบคทีเรียรูปแท่ง) ที่มีความยาว 1.5-2 ไมครอนและกว้าง 0.5 ไมครอน มันมี flagelo เดียวตั้งอยู่ในหนึ่งในเสาของมัน มันมีเยื่อหุ้มเซลล์ไซโตพลาสซึมล้อมรอบด้วยผนังบาง ๆ ของ peptidoglycan.
เยื่อหุ้มชั้นนอกมีโครงสร้างที่ซับซ้อนมากขึ้นซึ่งเกิดขึ้นจากฟอสโฟไลปิด, ไลโปโปรตีน, ลิโพโพลีแซคคาไรด์และโซ่โพลีแซคคาไรด์.
โครงการเยื่อหุ้มชั้นนอกไปสู่โซ่ของโพลีแซคคาไรด์ที่มีความสามารถในการยึดเกาะของแบคทีเรียและสร้างแผ่นชีวะ.
นอกจากนี้ถัดจากผนังเซลล์จะช่วยปกป้องไซโทพลาสซึมจากเกลือน้ำดีและเอนไซม์ไฮโดรไลติกที่ผลิตโดยระบบทางเดินอาหารของมนุษย์.
ที่อยู่อาศัย
มันมีที่อยู่อาศัยที่แตกต่างกันสองแบบ: สภาพแวดล้อมทางน้ำและลำไส้ของมนุษย์ ในช่วงฟรี, Vibrio cholerae มันพัฒนาในน้ำอุ่นที่มีความเค็มต่ำ.
มันสามารถอาศัยอยู่ในแม่น้ำทะเลสาบบ่อน้ำบริเวณปากแม่น้ำหรือในทะเล มันเป็นโรคประจำถิ่นในแอฟริกาเอเชียอเมริกาใต้และอเมริกากลาง จากนั้นในฐานะเหมือนกาฝากมันจะเข้าสู่ลำไส้เล็กของมนุษย์.
แบคทีเรียสามารถพบได้ในพื้นที่ของชายหาดเขตร้อนในน้ำที่มีความเค็ม 35% และอุณหภูมิ 25 ° C.
การปรากฏตัวของ Vibrio cholerae จุลชีพก่อโรคในพื้นที่แห้งแล้งและดอนในแอฟริกา นี่บ่งชี้ว่าสปีชีส์สามารถอยู่รอดได้ในแอมพลิจูดของการเปลี่ยนแปลงที่อยู่อาศัยสูงกว่าที่คิดไว้.
บางการศึกษาแสดงให้เห็นว่า Vibrio cholerae มันเป็นแบคทีเรียป่าในแหล่งน้ำจืดในป่าเขตร้อน.
วงจรการสืบพันธุ์และวงจรชีวิต
ในฐานะที่เป็นแบคทีเรียมันจะสร้างซ้ำโดยฟิชชันแบบไบนารีหรือแบบแยกส่วน. Vibrio cholerae ยังคงอยู่ในน้ำเป็นอิสระแพลงก์ตอน vibrios หรือ vibrios มวลรวม.
มวลรวมของ vibrios สร้าง biofilms ในแพลงก์ตอนพืชแพลงก์ตอนสัตว์ฝูงไข่แมลง exoskeletons, detritus และแม้แต่ในพืชน้ำ พวกเขาใช้ไคตินเป็นแหล่งของคาร์บอนและไนโตรเจน.
แผ่นชีวะประกอบด้วยแบคทีเรียซ้อนกันล้อมรอบด้วยช่องทางน้ำยึดติดกันและตั้งต้นโดยการผลิตโพลีแซคคาไรด์ภายนอก มันเป็นชั้นบาง ๆ ของแบคทีเรีย.
การสัมผัสกับสิ่งแวดล้อมนั้นเกิดจากการบริโภคอาหารหรือน้ำที่ปนเปื้อน เมื่อเข้าไปในระบบย่อยอาหารแบคทีเรียจะตั้งตัวเป็นเซลล์บุผิวของลำไส้เล็ก.
ต่อจากนั้น vibrio ถูกยึดติดกับเยื่อเมือกโดยใช้วิธีพิลีและโปรตีนพิเศษ จากนั้นจะเริ่มการคูณและการหลั่งของอหิวาตกโรคสารพิษ สารพิษนี้ส่งเสริมอาการท้องเสียซึ่งแบคทีเรียกลับเข้าสู่สภาพแวดล้อมภายนอก.
อาหารการกิน
แบคทีเรียนี้มีเมแทบอลิซึมที่ขึ้นอยู่กับการหมักกลูโคส ในรัฐอิสระจะได้รับอาหารในรูปของคาร์บอนและไนโตรเจนจากแหล่งอินทรีย์ต่าง ๆ บางส่วนของเหล่านี้เป็นไคตินหรือคาร์บอน exuded โดยสาหร่ายแพลงก์ตอนพืช.
สำหรับการดูดซึมของธาตุเหล็กสายพันธุ์ผลิต siderophor vibriobactin Vibriobactin เป็นสารประกอบคีเลตเหล็กที่ละลายแร่นี้ช่วยให้มันถูกดูดซึมโดยการขนส่งที่ใช้งานอยู่.
ในสภาพแวดล้อมทางน้ำมันตอบสนองฟังก์ชั่นที่สำคัญที่เกี่ยวข้องกับโภชนาการในระบบนิเวศ มีส่วนช่วยในการลดปริมาณคาร์บอนอินทรีย์และแร่ธาตุ.
ในทางกลับกันมันเป็นแบคทีเรีย ทั้งหมดนี้กำหนดบทบาทที่เกี่ยวข้องเป็นส่วนหนึ่งของ bacterioplankton ในลูปจุลินทรีย์หรือเครือข่ายโภชนาการจุลินทรีย์ในระบบนิเวศทางน้ำ.
Vibrio cholerae ดำเนินการกระบวนการพื้นฐานในการย่อยอาหารของมันออกไปข้างนอกผ่านสารที่มันหลั่งออกมา กลไกนี้คล้ายกับแบคทีเรียตัวอื่น.
สปีชีส์ทำหน้าที่บนพื้นผิวทำให้เกิดการสลายตัวขององค์ประกอบแร่ธาตุที่จำเป็นสำหรับโภชนาการของมันซึ่งจะถูกดูดซึมในภายหลัง นอกจากนี้ในการค้นหาและแปรรูปอาหารพวกมันยังโจมตีแบคทีเรียอื่น ๆ พวกเขาอาจโจมตีสายพันธุ์เดียวกัน แต่ไม่สายพันธุ์ของตัวเอง.
เพื่อฆ่าเชื้อแบคทีเรียอื่น ๆ, V. cholerae ใช้กลไกที่เรียกว่า Type VI secretion system (T6SS) ระบบนี้คล้ายกับฉมวกที่เจาะผนังเซลล์ของแบคทีเรียแกรมลบอื่น ๆ ที่ทำให้พวกเขาตาย.
ดังนั้นสารประกอบทางโภชนาการของแบคทีเรียเหล่านี้จึงมีอยู่ T6SS คล้ายกับระบบที่ใช้โดย bacteriophages เพื่อฉีดวัคซีนข้อมูลทางพันธุกรรมของพวกเขาในเซลล์แบคทีเรีย ระบบนี้อาจใช้โดย Vibrio cholerae เพื่อฉีดวัคซีนพิษในเซลล์เยื่อบุผิว.
pathogeny
การส่งผ่าน
แบคทีเรียจะถูกส่งผ่านเส้นทางอุจจาระทางปากไม่ว่าจะเป็นคนสู่คนโดยน้ำวัตถุหรืออาหารที่มีการปนเปื้อน อหิวาตกโรคเป็นระเบิดเมื่อมันเกิดขึ้นในประชากรที่ไม่มีภูมิคุ้มกันก่อนหน้านี้.
เป็นเวลาหลายปีที่คิดว่าเส้นทางหลักของการแพร่กระจายของโรคคือการกลืนกินน้ำที่ปนเปื้อน ทุกวันนี้เป็นที่ทราบกันดีว่ามีอาหารที่สามารถเป็นพาหนะสำหรับส่งกำลัง Vibrio cholerae. อาหารเหล่านี้ ได้แก่ หอยกาบหอยแมลงภู่กุ้งและปู.
ต้องใช้หัวเชื้อปริมาณสูงเพื่อให้ผู้ป่วยแต่ละคนมีสุขภาพแข็งแรงประมาณ 10 คน5 - 108 แบคทีเรีย อย่างไรก็ตามเชื้อจำนวนเล็กน้อยมีความเพียงพอในผู้ที่อ่อนแอหรือขาดสารอาหาร ระยะฟักตัวของโรคมีตั้งแต่ 6 ชั่วโมงถึง 5 วัน.
ระบาดวิทยา
แม้ว่าจะมีข้อมูลเกี่ยวกับโรคระบาดอหิวาตกโรคมาตั้งแต่ศตวรรษที่ 14 แต่การระบาดครั้งแรกของเอกสารฉบับวันที่กลับสู่ต้นศตวรรษที่ 19 ระหว่างปีพ. ศ. 2360 และ 2466 มีการระบาดของอหิวาตกโรคที่รู้จักกันอย่างน้อยหกตัว Vibrio cholerae.
การแพร่ระบาดครั้งนี้เริ่มขึ้นในอินเดียส่วนใหญ่มาจากสามเหลี่ยมปากแม่น้ำคงคา เมื่อมาถึงตะวันออกกลางก็ขยายจากที่นั่นไปยังยุโรป อีกวิธีหนึ่งในการเข้าสู่ยุโรปคือทะเลเมดิเตอร์เรเนียนผ่านทางคาราวานที่มาจากประเทศอาระเบีย จากยุโรปมาถึงอเมริกา.
ตั้งแต่ปีพ. ศ. 2466 ถึง 2504 มีช่วงเวลาหนึ่งที่ไม่มีการระบาดใหญ่ของโรคนี้และมีเพียงผู้ป่วยอหิวาตกโรคเท่านั้นที่เป็นที่รู้จัก จากปี 1961 มันปรากฏขึ้นพร้อมกับชีวประวัติใหม่ที่ชื่อว่าทอร์ซึ่งทำให้เกิดการระบาดใหญ่ครั้งที่เจ็ด.
นับตั้งแต่ทศวรรษ 1990 มีการระบุซีโรกรุ๊ปมากกว่า 200 รายการและรูปแบบที่ผิดปกติของทอร์ ในปี 1991 มีการระบาดของโรคอหิวาต์ที่แปดเกิดขึ้น ปัจจุบันผู้ป่วยอหิวาตกโรคส่วนใหญ่ถูก จำกัด อยู่ที่ภูมิภาคย่อยของทะเลทรายซาฮารา, อินเดีย, เอเชียตะวันออกเฉียงใต้และบางพื้นที่ของแคริบเบียน ในภูมิภาคเหล่านี้มันกลายเป็นโรคประจำถิ่น.
รูปแบบของการกระทำ
แบคทีเรียผลิตสารพิษหลายชนิด แต่อาการขาดน้ำแบบ diarrheic คลาสสิกของโรคที่เกิดจากอหิวาตกโรค enterotoxin (CT).
มันถูกสร้างขึ้นโดยหน่วยย่อย B ปลอดสารพิษและหน่วยย่อยที่ใช้งานเอนไซม์ หน่วยย่อย B ทำหน้าที่ในตัวรับของเซลล์เยื่อบุผิวของลำไส้เล็ก Subunit A เปิดใช้งาน adenylate cyclase.
enterotoxin จับกับเซลล์ของเยื่อบุลำไส้ผ่านพิลีแบคทีเรียและทำให้เกิดอาการท้องร่วงและการขาดน้ำโดยการเปิดใช้งานเอนไซม์ adenylate cyclase.
สิ่งนี้นำไปสู่การเพิ่มการผลิตของเซลล์ adenosine monophosphate ภายในเซลล์ซึ่งทำให้เซลล์เมือกสูบน้ำและอิเล็กโทรไลจำนวนมาก.
Vibrio cholerae ปล่อยสารพิษอื่น ๆ เช่น ZOT และ ACE พวกมันทำหน้าที่ต่อต้านเซลล์ของระบบภูมิคุ้มกันที่สามารถกำจัด vibrios (กรณี IgG) พวกเขายังสามารถต่อต้านอหิวาตกโรค enterotoxin (กรณี IgA).
อาการและการรักษา
ในบรรดาอาการคือ hypovolemic ช็อต, อาเจียน, ท้องร่วง, ดิสก์, ปวดกล้ามเนื้อ, ผิวแห้ง, ตาเคลือบหรือจม, อัตราการเต้นของหัวใจสูงง่วงและง่วง.
ในพื้นที่ถิ่นมีการตรวจพบแบคทีเรียในคนที่อยู่ใกล้กับผู้ป่วยอหิวาตกโรค ผู้ป่วยไม่มีอาการที่มองเห็นของโรคบ่งบอกถึงการดำรงอยู่ของบุคคลที่ไม่มีอาการ.
อหิวาตกโรคสามารถป้องกันได้และมีวัคซีนป้องกันโรคในช่องปากได้ถึง 60-66% อย่างไรก็ตามการระบาดสามารถเกิดจากเหตุการณ์ธรรมชาติหรือเกิดจากมนุษย์ สิ่งนี้เกิดขึ้นเมื่อสร้างมลภาวะทางน้ำหรือลดการเข้าถึงน้ำดื่มและการสุขาภิบาล.
การบำบัดน้ำที่เหมาะสมและทันเวลาสามารถลดอัตราการตายให้น้อยกว่า 1% การรักษาด้วยยาปฏิชีวนะสามารถลดการปล่อย vibrios อย่างไรก็ตามไม่มีมาตรการรักษาใดที่เปลี่ยนแปลงการแพร่กระจายของโรคได้อย่างมีนัยสำคัญ.
ยาปฏิชีวนะที่ใช้กันทั่วไปในผู้ใหญ่คือกลุ่ม Doxycline และ Tetracycline ในผู้หญิงที่กำลังตั้งครรภ์จะใช้ nitrofuran Furazolidone ในเด็กแนะนำให้ใช้ Sulfamethoxazole และ trimethoprim (SMZ + TMP).
องค์ประกอบพื้นฐานสำหรับการควบคุมโรคระบาดคือการจัดการสุขอนามัยที่เพียงพอของน้ำเสียและสภาวะสุขาภิบาลโดยทั่วไป ในแง่นี้อหิวาตกโรคเป็นโรคที่เกี่ยวข้องกับเงื่อนไขของความยากจน.
การปรากฏตัวของ Vibrio cholerae ในร่างกายถูกตรวจพบด้วยการทดสอบในห้องปฏิบัติการเช่น PCR, ELISA หรือการใช้สื่อการคัดเลือกวัฒนธรรม.
การอ้างอิง
- Baker-Austin, C. , Trinanes, J. , Gonzalez-Escalona, N. และ Martinez-Urtaza, J. (2017) Non-cholera vibrios: บารอมิเตอร์จุลินทรีย์ของการเปลี่ยนแปลงสภาพภูมิอากาศ เทรนด์ไมโครไบโอ 25, 76-84.
- Faruque, S.M. , Albert, M.J. และ Mekalanos, J. J. (1998) ระบาดวิทยาพันธุศาสตร์และนิเวศวิทยาของสารพิษ Vibrio cholerae. จุลชีววิทยาและอณูชีววิทยาความคิดเห็น 66 (4); 1301-1314.
- Faruque, S. M. และ G. Balakrish Nair, G. B. (บรรณาธิการ) (2008) Vibrio cholerae ฟังก์ชั่นและอณูชีววิทยา Caister Academic Press บังคลาเทศ 218 หน้า.
- Glass R.I. , Black R.E. (1992) ระบาดวิทยาของอหิวาตกโรค (หน้า 129-154). ใน: Barua D. , Greenough (eds) อหิวาตกโรค หัวข้อปัจจุบันเกี่ยวกับโรคติดเชื้อ สปริงเกอร์บอสตันนิวยอร์ก.
- Kierek, K. และ Watnick, P. I. (2003) ปัจจัยทางสิ่งแวดล้อมของการพัฒนาฟิล์มชีวภาพ Vibrio cholerae จุลชีววิทยาประยุกต์และสิ่งแวดล้อม. 69 (9); 5079-5088.
- Perez-Rosas, N. และ Hazent, T. C. (1989) ในการอยู่รอดของ Vibrio cholerae และ Escherichia coli ในป่าฝนเขตร้อน จุลชีววิทยาประยุกต์และสิ่งแวดล้อม. 55 (2): 495-499.
- Zuckerman, J. N. , Rombo, L. และ Fisch, A. (2017) ภาระและความเสี่ยงที่แท้จริงของอหิวาตกโรค: ผลกระทบต่อการป้องกันและควบคุม มีดหมอ รีวิวโรคติดเชื้อ 7 (8): 521-530.


