ลักษณะโครงสร้างและประเภทของฮิสโตนามิ
histones เป็นโปรตีนพื้นฐานที่มีปฏิสัมพันธ์กับ DNA ในการสร้างนิวคลีโอโซมซึ่งประกอบไปด้วยโครมาตินเป็นส่วนประกอบของโครโมโซมในสิ่งมีชีวิตยูคาริโอต.
นิวคลีโอโซมคอมเพล็กซ์ที่เกิดจาก DNA และโปรตีนถูกค้นพบในปี 1974 และมันเป็นฮิสโทนิกที่ประกอบระดับโครเมียมพื้นฐานนี้ อย่างไรก็ตามการมีอยู่ของโปรตีนฮิสโตนเป็นที่รู้จักกันมาตั้งแต่ก่อนปี 1960.
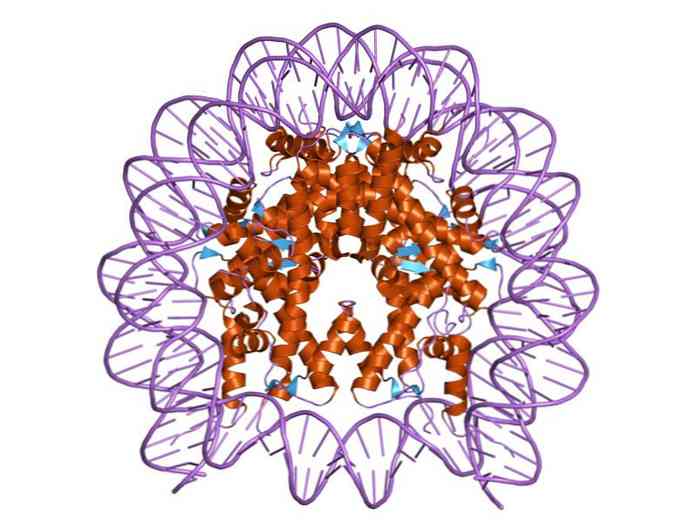
ฮิสโทนิมีการจัดระเบียบในลักษณะที่วงดีเอ็นเอคู่ถูกพันรอบศูนย์โปรตีนที่ประกอบด้วยโปรตีนเหล่านี้ที่มีปฏิสัมพันธ์อย่างใกล้ชิดกัน ศูนย์ฮิสโตนมีรูปร่างเป็นแผ่นดิสก์และดีเอ็นเอให้ประมาณ 1.7 รอบมัน.
พันธะไฮโดรเจนหลายพันธะช่วยให้การจับตัวของดีเอ็นเอไปยังศูนย์กลางโปรตีนที่เกิดขึ้นโดยฮิสโตนในแต่ละนิวคลีโอโซม พันธบัตรเหล่านี้เกิดขึ้นส่วนใหญ่อยู่ระหว่างโครงกระดูกของกรดอะมิโนของฮิสโตนกับกระดูกสันหลังของน้ำตาล - ฟอสเฟตของ DNA ปฏิกิริยาที่ไม่ชอบน้ำและพันธะไอออนิกก็มีส่วนร่วมเช่นกัน.
โปรตีนที่เรียกว่า "chromatin remodeling complexes" มีหน้าที่รับผิดชอบในการสลายและการก่อตัวของพันธะผูกพันระหว่าง DNA และ histones ทำให้สามารถเข้าสู่กลไกการถอดรหัสลงใน DNA ที่อยู่ในนิวเคลียส.
แม้จะมีความใกล้ชิดของกรดนิวคลีอิกไปยังศูนย์โปรตีนที่เกิดขึ้นโดยฮิสโตนเหล่านี้จะถูกจัดเรียงในลักษณะที่ถ้าจำเป็นพวกเขาอนุญาตให้เข้าสู่ปัจจัยการถอดความและโปรตีนอื่น ๆ ที่เกี่ยวข้องกับการแสดงออกหรือการเงียบสงบทางพันธุกรรม.
ฮิสโตนสามารถรับการดัดแปลงต่าง ๆ ที่สร้างความหลากหลายได้ทำให้การดำรงอยู่ของโครมาตินในรูปแบบต่าง ๆ มากมายซึ่งมีคุณสมบัติในการปรับการแสดงออกของยีนในรูปแบบต่าง.
ดัชนี
- 1 ลักษณะ
- 2 โครงสร้าง
- 2.1 Union histones
- 3 ประเภท
- 3.1 Nucleosomal histones
- 3.2 Union histones
- 4 ฟังก์ชั่น
- 5 อ้างอิง
คุณสมบัติ
พวกมันเป็นโปรตีนยูคาริโอตที่ได้รับการอนุรักษ์มากที่สุดในธรรมชาติ มันแสดงให้เห็นว่าตัวอย่างเช่นถั่วฮิสโตน H4 นั้นแตกต่างกันในสองตำแหน่งกรดอะมิโน 102 ตัวของโปรตีนโคโปรตีน H4.
ฮิสโตนเป็นโปรตีนที่ค่อนข้างเล็กโดยมีกรดอะมิโนไม่เกิน 140 ตัว พวกเขาอุดมไปด้วยกรดอะมิโนพื้นฐานที่ตกค้างดังนั้นพวกเขาจึงมีประจุสุทธิเป็นบวกซึ่งก่อให้เกิดการมีปฏิสัมพันธ์กับกรดนิวคลีอิกซึ่งมีประจุเป็นลบ.
นิวคลีโอโซมาลและฮิสโทนิกหรือฮิสโทสบริดจ์เป็นที่รู้จักกันดี นิวคลีโอโซมฮีสต์คือ H3, H4, H2A และ H2B ในขณะที่ฮิสโตนจับยึดอยู่ในตระกูล H1 ฮิสโตน.
ในระหว่างการประกอบของนิวเคลียสจะมีการสร้าง dimers เฉพาะ H3-H4 และ H2A-H2B H3-H4 dimers สองตัวจะถูกรวมเข้ากับ tetramers ซึ่งจะรวมเข้ากับ dimers H2A-H2B ซึ่งก่อตัวเป็นศูนย์กลางของ octameric.
ฮิสโตนทั้งหมดจะถูกสังเคราะห์ส่วนใหญ่ในช่วง S ของวัฏจักรเซลล์และนิวคลีโอโซมจะรวมตัวกันเป็นเอ็นไซม์ดีเอ็นเอที่เพิ่งตั้งขึ้นใหม่หลังจากที่ทำการแยกการจำลองแบบ.
โครงสร้าง
โครงสร้างทั่วไปของฮิสโตนประกอบด้วยบริเวณกรดอะมิโนพื้นฐานและบริเวณคาร์บอกซิลทรงกลมที่ได้รับการอนุรักษ์อย่างสูงในหมู่สิ่งมีชีวิตยูคาริโอต.
แม่ลายโครงสร้างที่รู้จักกันในนาม "ฮิสโตนพับ" ประกอบด้วยสามอัลฟาเอนริเก้เชื่อมต่อกันด้วยสองส้อมและก่อตัวเป็นศูนย์กลางที่ไม่ชอบน้ำขนาดเล็กเป็นผู้รับผิดชอบการปฏิสัมพันธ์ระหว่างโปรตีนและโปรตีนระหว่างฮิสโตนที่ประกอบเป็นนิวเคลียส.
นี่คือการพับของ histones ที่ทำให้โดเมน carboxyl ทรงกลมของโปรตีนนิวคลีโอโซมกล่าวในยูคาริโอตทั้งหมด.
Histones ยังมี "ก้อย" เล็ก ๆ หรืออะมิโน - เทอร์มินัลและบริเวณอื่น ๆ ของคาร์บอกซิล (สามารถเข้าถึงโปรติเอส) ที่มีความยาวไม่เกิน 40 กรดอะมิโน ทั้งสองภูมิภาคอุดมไปด้วยกรดอะมิโนพื้นฐานที่สามารถผ่านการดัดแปลงโควาเลนต์ได้หลายครั้ง.
ยูเนี่ยนฮีส
ในยูคาริโอตมีสองตระกูลของฮีสโตนของสหภาพซึ่งแตกต่างจากโครงสร้างของพวกเขา บางคนมีโครงสร้างไตรภาคีที่มีโดเมนทรงกลมที่อธิบายไว้ข้างต้นขนาบข้างด้วยโดเมน N - และ C-terminal "ไม่มีโครงสร้าง"; ในขณะที่คนอื่นมีเพียงโดเมน C-terminal.
แม้ว่า histones ส่วนใหญ่จะได้รับการอนุรักษ์ตัวแปรเฉพาะบางอย่างอาจเกิดขึ้นในช่วงตัวอ่อนหรือการเจริญเติบโตของเซลล์พิเศษในสิ่งมีชีวิตบางชนิด ความผันแปรทางโครงสร้างบางอย่างเกี่ยวข้องกับการดัดแปลงหลังการแปลเช่นสิ่งต่อไปนี้:
-phosphorylation: มันเป็นความคิดที่เกี่ยวข้องกับการเปลี่ยนแปลงระดับของการควบแน่นของ chromatin และพบได้ทั่วไปในซีรีนตกค้าง.
-acetylation: เกี่ยวข้องกับภูมิภาคของโครโมโซมที่มีการใช้งาน transcriptionally มันมักจะเกิดขึ้นในโซ่ด้านข้างของสารตกค้างไลซีน เมื่อเกิดสิ่งตกค้างเหล่านี้ประจุบวกจะลดลงทำให้ความสัมพันธ์ของโปรตีนกับ DNA ลดลง.
-methylation: สามารถให้เป็น mono-, di- หรือ tri- metilaciónของไลซีนที่ตกค้างจากแกนโปรตีน.
เอ็นไซม์เฉพาะนั้นมีหน้าที่ในการทำการดัดแปลงโควาเลนต์เหล่านี้ในฮิสโตน เอ็นไซม์เหล่านี้ ได้แก่ ฮิสโตนอะซิติลทรานสเฟอร์เรส (HATs) คอมเพล็กซ์ฮิสโตน - ดีอาเซติเลส (HDAC) และฮิสโตน - เมธิลทรานเฟอร์เรส.
ชนิด
การศึกษาลักษณะของฮิสโตนได้ดำเนินการโดยเทคนิคทางชีวเคมีที่หลากหลายซึ่งโครมาโตกราฟฟีซึ่งมีพื้นฐานมาจากเรซินแลกเปลี่ยนไอออนบวกที่อ่อนแอนั้นโดดเด่น.
ผู้เขียนบางคนสร้างวิธีการจำแนกประเภทซึ่งมีฮิสโตนหลัก 5 ชนิดที่มีความโดดเด่นในยูคาริโอต: FI, ด้วยโปรตีน 21 kDa; F2A1 หรือ FIV, จากบวกหรือลบ 11.3 kDa; F2A2 หรือ FIIbI, 14.5 kDa; F2B หรือ FIIb2 มีน้ำหนักโมเลกุล 13.7 kDa และ F3 หรือ FIII ที่ 15.3 kDa.
ฮิสโตนชนิดทั้งหมดเหล่านี้ยกเว้นกลุ่ม FI ถูกพบในจำนวน Equimolar ในเซลล์.
การจำแนกประเภทอื่นที่มีความถูกต้องเหมือนกันและอาจจะใช้กันมากที่สุดในปัจจุบันเสนอการมีอยู่ของฮิสโตนสองประเภทที่แตกต่างกัน ได้แก่ : พวกที่เป็นส่วนหนึ่งของออคโทเมอร์นิวคลีโอโซมและทางแยกหรือสะพานฮิสโตน ใช่.
บางสายพันธุ์สามารถเกิดขึ้นได้ระหว่างสปีชีส์และไม่เหมือนกับนิวเคลียสฮิสโตน, สายพันธุ์จะถูกสังเคราะห์ขึ้นในส่วนต่อประสานและถูกแทรกเข้าไปในโครมาติน preformed ผ่านกระบวนการขึ้นอยู่กับพลังงานที่ปลดปล่อยจากการไฮโดรไลซิสของ ATP.
นิวคลีโอโซม
นิวเคลียสของนิวคลีโอโซมประกอบด้วยคู่ของแต่ละคู่ของ Histone ที่เป็นส่วนประกอบทั้งสี่: H2a, H2b, H3 และ H4; ซึ่งส่วนดีเอ็นเอประมาณ 145 คู่เบสถูกห่อ.
โดยทั่วไปแล้ว histones H4 และ H2B นั้นคงที่ การเปลี่ยนแปลงบางอย่างเห็นได้ชัดอย่างไรก็ตามใน histones H3 และ H2A ซึ่งคุณสมบัติทางชีวฟิสิกส์และชีวเคมีเปลี่ยนแปลงธรรมชาติของนิวคลีโอโซม.
ตัวแปรของฮิสโตน H2A ในมนุษย์โปรตีน H2A.Z มีพื้นที่ที่เป็นกรดขนาดใหญ่และสามารถสนับสนุนความเสถียรของนิวคลีโอโซมขึ้นอยู่กับฮิสโตน H3 ซึ่งมีความเกี่ยวข้อง.
ฮิสโตนเหล่านี้แสดงความแปรปรวนระหว่างสปีชีส์เป็นกรณีพิเศษของฮิสโตน H2B ซึ่งหนึ่งในสามของโมเลกุลนั้นมีความผันแปรสูง.
ยูเนี่ยนฮีส
ทางแยกหรือสะพานเชื่อมเป็นกระแสของชั้น H1 สิ่งเหล่านี้มีหน้าที่รับผิดชอบการรวมตัวระหว่างนิวคลีโอโซมและการป้องกันดีเอ็นเอที่ยื่นออกมาที่จุดเริ่มต้นและจุดสิ้นสุดของแต่ละอนุภาค.
ซึ่งแตกต่างจาก nucleosomal histones ไม่ใช่ histones ทั้งหมดของชนิด H1 มีพื้นที่ทรงกลมของ "เท่า" ของ histones โปรตีนเหล่านี้จับกับดีเอ็นเอระหว่างนิวคลีโอโซมช่วยให้เกิดการเปลี่ยนแปลงของความสมดุลของโครมาตินไปสู่สถานะที่มีความเข้มข้นมากขึ้นและมีความว่องไวน้อยลง.
การศึกษาได้เชื่อมโยง histones เหล่านี้เข้ากับอายุการซ่อมแซม DNA และกระบวนการ apoptotic ดังนั้นจึงคิดว่าพวกเขามีบทบาทสำคัญในการบำรุงรักษาความสมบูรณ์ของจีโนม.
ฟังก์ชั่น
กรดอะมิโนทั้งหมดที่ตกค้างของ histones มีส่วนร่วมไม่ทางใดก็ทางหนึ่งในการมีปฏิสัมพันธ์กับ DNA ซึ่งอธิบายถึงความจริงที่ว่าพวกเขาได้รับการอนุรักษ์ในอาณาจักรของสิ่งมีชีวิตยูคาริโอต.
การมีส่วนร่วมของฮิสโตนในบรรจุภัณฑ์ของ DNA ในรูปแบบของโครมาตินนั้นมีความเกี่ยวข้องอย่างมากสำหรับสิ่งมีชีวิตหลายเซลล์ที่ซับซ้อนซึ่งเซลล์ต่าง ๆ สามารถสร้างความเชี่ยวชาญเฉพาะโดยการเปลี่ยนการเข้าถึงยีนของพวกเขาเป็นเครื่องจักรการถอดเสียง.
บริเวณจีโนมที่มีการใช้งาน Transcriptionally มีความหนาแน่นสูงในนิวคลีโอโซมแสดงให้เห็นว่าการเชื่อมโยงของ DNA กับโปรตีนฮิสโตนมีความสำคัญสำหรับการควบคุมเชิงลบ.
ในทำนองเดียวกันตลอดชีวิตของเซลล์การตอบสนองต่อสิ่งเร้าจำนวนมากทั้งภายในและภายนอกนั้นขึ้นอยู่กับการเปลี่ยนแปลงเล็กน้อยในโครมาตินซึ่งโดยทั่วไปแล้วจะเกี่ยวข้องกับการเปลี่ยนแปลงหลังการเปลี่ยนแปลงและการเปลี่ยนแปลงของฮิสโตนที่พบใน ความสัมพันธ์ใกล้ชิดกับ DNA.
หลายตัวแปรฮิสโตนออกแรงฟังก์ชั่นที่แตกต่างกันในยูคาริโอต หนึ่งในนั้นเกี่ยวข้องกับการมีส่วนร่วมของฮิสโตน H3 ในการก่อตัวของโครงสร้าง centromeric ที่รับผิดชอบในการแยกของโครโมโซมในช่วง mitosis.
มันแสดงให้เห็นว่าคู่ของโปรตีนนี้ในยูคาริโอตอื่น ๆ เป็นสิ่งจำเป็นสำหรับการชุมนุมของ kinetochore โปรตีนที่ microtubules แกนหมุนผูกระหว่าง mitosis และไมโอซิส.
การอ้างอิง
- Alberts, B. , Johnson, A. , Lewis, J. , Morgan, D. , Raff, M. , Roberts, K. , & Walter, P. (2015) อณูชีววิทยาของเซลล์ (6 ed.) นิวยอร์ก: วิทยาศาสตร์การ์แลนด์.
- Campos, E. I. , & Reinberg, D. (2009) Histones: การเพิ่มความคิดเห็น Chromatin Annu Rev. Genet, 43, 559-599.
- Harvey, A. C. , & Downs, J. A. (2004) ฟังก์ชั่นทำอะไร linker histones ให้? จุลชีววิทยาโมเลกุล, 53, 771-775.
- Henikoff, S. , & Ahmad, K. (2005) การประกอบชุดตัวแปรประวัติศาสตร์ลงใน Chromatin Annu รายได้เซลล์ Dev. Biol., 21, 133-153.
- Isenberg, I. (1979) histones Annu รายได้ Biochem, 48, 159-191.
- Kornberg, R. D. , & Thomas, J. O. (1974) โครงสร้าง Chromatin: Oligomers ของ Histones วิทยาศาสตร์, 184 (4139), 865-868.
- สมิ ธ , E. , DeLange, R. , & Bonner, J. (1970) เคมีและชีววิทยาของ Histones รีวิวสรีรวิทยา, 50 (2), 159-170.


