สูตรโซเดียมซัลไฟด์, การใช้, ความเสี่ยง
โซเดียมซัลไฟด์ (Na2S) เป็นผลึกของแข็งจากสีเหลืองเป็นสีแดงอิฐ ในธรรมชาตินั้นจะพบได้ในระดับที่แตกต่างกันของความชุ่มชื้นเป็นโซเดียมซัลไฟด์โนนาไฮเดรทที่พบมากที่สุด (Na2S · 9H2O).
พวกเขาเป็นเกลือละลายน้ำที่ให้สารละลายด่างอย่างยิ่ง เมื่อสัมผัสกับอากาศชื้นพวกมันดูดซับความชื้นจากอากาศซึ่งสามารถทำให้ร้อนขึ้นเองและทำให้เกิดการลุกไหม้ของวัสดุที่ติดไฟได้ในบริเวณใกล้เคียง ในทำนองเดียวกันเมื่อสัมผัสกับอากาศชื้นพวกมันปล่อยไฮโดรเจนซัลไฟด์ซึ่งมีกลิ่นเหมือนไข่เน่า.

พวกเขาเป็นตัวแทนลดที่แข็งแกร่ง สารเหล่านี้อาจเป็นอันตรายต่อสิ่งแวดล้อมโดยเฉพาะสิ่งมีชีวิตในน้ำ.
Sodium monosulfide มีวางจำหน่ายทั่วไปในรูปแบบของเกล็ดที่มี 60-62% Na2ส.
- สูตร

- CAS: 1313-82-2 โซเดียมซัลไฟด์ (รัส)
- CAS: 1313-84-4 โซเดียมซัลไฟด์ (ไม่มีโซเดียม)
โครงสร้าง 2D
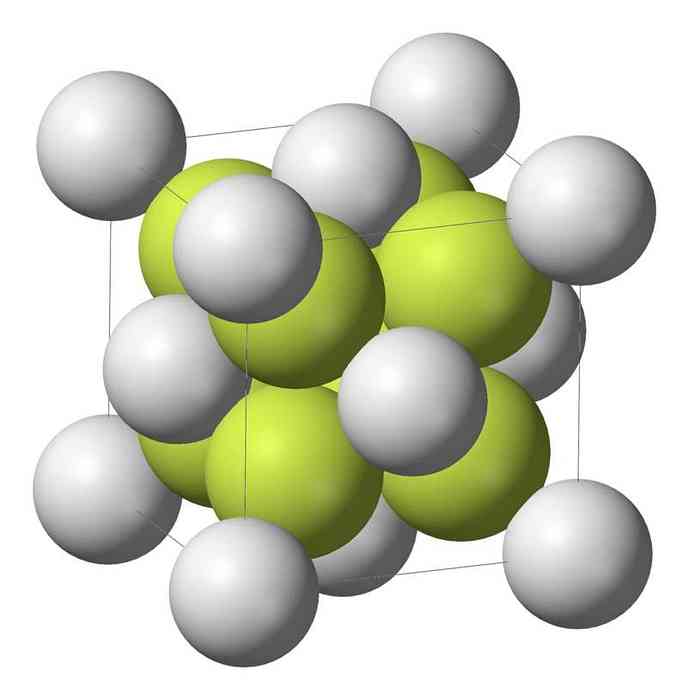
โครงสร้าง 3 มิติ
ลักษณะของโซเดียมซัลไฟด์
คุณสมบัติทางกายภาพและทางเคมี

Sodium monosulfide (Na2S) ตกผลึกด้วยโครงสร้าง antifluorite ซึ่งแต่ละอะตอม S ล้อมรอบด้วยลูกบาศก์ Na Na 8 ก้อนและ Na Na แต่ละอะตอมโดย tetrahedral 4 อะตอม.
การลุกไหม้ได้
สมาชิกที่ติดไฟได้ง่ายมากในกลุ่มอนินทรีย์ซัลไฟด์คือไฮโดรเจนซัลไฟด์ อย่างไรก็ตามซัลไฟด์อนินทรีย์อื่น ๆ เช่นโซเดียมซัลไฟด์สามารถให้ความร้อนตามธรรมชาติและติดไฟได้เองหากสัมผัสกับความชื้น.
เมื่อสัมผัสกับไฟโซเดียมซัลไฟด์จะปล่อยแก๊สหรือไอระเหยของซัลเฟอร์ไดออกไซด์ซึ่งทำให้ระคายเคืองหรือเป็นพิษ.
การเกิดปฏิกิริยา
- โดยทั่วไปแล้วอนินทรีย์ซัลไฟด์เป็นพื้นฐาน (บางอย่างเป็นพื้นฐานอย่างยิ่งและเข้ากันไม่ได้กับกรด).
- สารประกอบเหล่านี้หลายตัวกำลังลดตัวลง (พวกมันจะทำปฏิกิริยาอย่างแรงกับตัวออกซิไดซ์).
- Simple salts of sulfides (เช่นโซเดียม, โปแตสเซียมและแอมโมเนียมซัลไฟด์) ทำปฏิกิริยาอย่างรุนแรงกับกรดเพื่อปล่อยก๊าซไฮโดรเจนซัลไฟด์ที่เป็นพิษและไวไฟสูง.
- โซเดียมซัลไฟด์ติดไฟได้ อาจระเบิดได้เมื่อถูกความร้อนอย่างรวดเร็วหรือถูกกระแทก.
- เมื่อถูกความร้อนจนถึงการสลายตัวจะปล่อยไอระเหยที่เป็นพิษของโซเดียมออกไซด์และซัลเฟอร์ออกไซด์.
- ทำปฏิกิริยารุนแรงกับคาร์บอนกับถ่าน, เกลือ diazonium, N, N-dichloromethylamine, สารออกซิแดนท์ที่แรงและน้ำ.
ความเป็นพิษ
สมาชิกของกลุ่มของอนินทรีย์ซัลไฟด์ทำหน้าที่เป็นฐานที่แข็งแกร่งและอาจทำให้เกิดแผลไหม้อย่างรุนแรงเมื่อสัมผัสกับผิวหนัง.
คุณสมบัตินี้ขึ้นอยู่กับความสามารถในการละลาย ซัลไฟด์อนินทรีย์ที่ไม่ละลายน้ำมากที่สุด (ตัวอย่างเช่นปรอท (II) ซัลไฟด์และแคดเมียมซัลไฟด์) ไม่กัดกร่อน.
โซเดียมซัลไฟด์มีค่าสัมประสิทธิ์การแยกออกเทนอลอล / น้ำ (Pow) ปานกลาง (-3.5) ค่านี้ใช้เป็นตัวชี้วัดความสามารถในการละลาย (และความเข้มข้นทางชีวภาพ) ของสารในเนื้อเยื่อไขมันของสัตว์ (โดยเฉพาะสัตว์น้ำ).
โซเดียมซัลไฟด์ถือว่าเป็นอันตรายต่อสิ่งแวดล้อมโดยเฉพาะสิ่งมีชีวิตในน้ำ.
การใช้งาน
ที่บ้านมีการใช้โซเดียมซัลไฟด์ในการเปิดท่อทำความสะอาดของใช้ในครัวเรือน (สำหรับเตาห้องน้ำ) เครื่องยืดผมสบู่ล้างจานและถุงลมนิรภัยอัตโนมัติ.
ในอุตสาหกรรมมันถูกใช้ในน้ำยาทำความสะอาดในปูนซีเมนต์และเป็นสารตั้งต้นในการผลิตผลิตภัณฑ์เคมีอื่น ๆ.
ผลทางคลินิก
การได้รับโซเดียมซัลไฟด์นั้นพบได้ทั่วไปในประเทศที่พัฒนาแล้วและประเทศด้อยพัฒนาทั้งในอุตสาหกรรมและที่บ้าน สารกัดกร่อนเหล่านี้มีอยู่ในผลิตภัณฑ์ในครัวเรือนหลายชนิดที่มีความเข้มข้นต่ำ.
ในประเทศที่พัฒนาแล้วผลกระทบร้ายแรงมีน้อยมาก สิ่งเหล่านี้เกิดขึ้นส่วนใหญ่เกิดจากการบริโภคสารเคมีอย่างรอบคอบในผู้ใหญ่ อย่างไรก็ตามในประเทศกำลังพัฒนาผลกระทบที่ร้ายแรงเป็นเรื่องธรรมดามากขึ้น.
การกัดกร่อนของอัลคาไลน์ทำให้เกิดเนื้อร้ายเนื่องจากของเหลว Saponify ไขมันในเยื่อหุ้มเซลล์ทำลายเซลล์และอนุญาตให้เจาะลึกเข้าไปในเนื้อเยื่อของเยื่อเมือก.
การได้รับสารทางปาก
การอักเสบเริ่มต้นเกิดขึ้นในเนื้อเยื่อของระบบทางเดินอาหารตามด้วยเนื้อร้ายเนื้อเยื่อ.
ผู้ป่วยที่มีการกลืนที่ไม่รุนแรงมีอาการระคายเคืองหรือแสบร้อนระดับหนึ่ง (ภาวะความดันโลหิตสูงและผิวบวมน้ำ) ของ oropharynx, หลอดอาหารหรือกระเพาะอาหาร.
ผู้ป่วยที่มีอาการมึนเมาระดับปานกลางอาจทำให้เกิดแผลไหม้ในระดับที่สอง (แผลพุพอง, การสึกกร่อนและแผล) ที่อาจก่อให้เกิดการตีบของหลอดเลือดต่อไป.
ผู้ป่วยบางราย (โดยเฉพาะเด็กเล็ก) อาจมีอาการบวมน้ำที่ทางเดินหายใจส่วนบน.
ผู้ป่วยที่มีอาการมึนเมารุนแรงจากการกลืนกินสามารถก่อให้เกิดแผลไหม้ลึกและเนื้อร้ายของเยื่อบุทางเดินอาหาร, มีภาวะแทรกซ้อนเช่น: การเจาะ (หลอดอาหาร, กระเพาะอาหาร, ลำไส้เล็กส่วนต้น), การสร้างทวาร (หลอดลม, เส้นเลือดใหญ่).
พวกเขาสามารถพัฒนา: ความดันเลือดต่ำ, อิศวร, tachypnea, การก่อตัวที่เข้มงวด (ส่วนใหญ่หลอดอาหาร), โรคมะเร็งหลอดอาหารและอาการบวมน้ำของระบบทางเดินหายใจส่วนบน (ซึ่งเป็นเรื่องปกติและมักจะคุกคามชีวิต).
พิษที่รุนแรงมัก จำกัด อยู่ที่การพิจารณาบริโภคในผู้ใหญ่.
การได้รับสัมผัสโดยการสูดดม
การเปิดรับแสงน้อยสามารถทำให้เกิดอาการไอและหลอดลม.
การสูดดมอย่างรุนแรงอาจทำให้เกิดอาการบวมน้ำที่ทางเดินหายใจส่วนบน, การเผา, stridor และ, ไม่ค่อยได้รับบาดเจ็บปอดเฉียบพลัน.
สัมผัสกับดวงตา
มันสามารถทำให้เกิดการระคายเคือง conjunctival รุนแรงและเคมีบำบัด, ข้อบกพร่องเยื่อบุผิวกระจกตา, ขาดเลือด limbic, สูญเสียการมองเห็นถาวรและในกรณีที่รุนแรงของการเจาะ.
การสัมผัสทางผิวหนัง
การสัมผัสเล็กน้อยทำให้เกิดการระคายเคืองและความหนาบางส่วนไหม้ การเผาผลาญกรดอาจพัฒนาในผู้ป่วยที่มีแผลไหม้หรือการกระแทกรุนแรง.
การได้รับสารเป็นเวลานานหรือผลิตภัณฑ์ที่มีความเข้มข้นสูงสามารถทำให้ความหนารวมไหม้.
ความปลอดภัยและความเสี่ยง
ข้อความแสดงความเป็นอันตรายของระบบที่กลมกลืนกันทั่วโลกสำหรับการจำแนกและการติดฉลากสารเคมี (SGA)
ระบบที่กลมกลืนกันทั่วโลกสำหรับการจำแนกประเภทและการปิดฉลากของสารเคมี (SGA) เป็นระบบที่ได้รับการยอมรับในระดับสากลสร้างขึ้นโดยสหประชาชาติและออกแบบมาเพื่อแทนที่มาตรฐานการจำแนกประเภทและการติดฉลากที่ใช้ในประเทศต่างๆ.
ประเภทความเป็นอันตราย (และบทที่เกี่ยวข้องของพวกเขาของ GHS) การจำแนกประเภทและมาตรฐานการติดฉลากและคำแนะนำสำหรับโซเดียมซัลไฟด์มีดังนี้ (สำนักงานเคมีภัณฑ์ยุโรป 2017, 2017, องค์การสหประชาชาติ, 2015, PubChem, 2017):







การอ้างอิง
- Benjah-bmm27, (2006) Fluorite-unit-cell-3D-ionic [ภาพ] สืบค้นจาก: wikipedia.org.
- ChemIDplus, (2017) 1313-82-2 [ภาพ] สืบค้นจาก: chem.nlm.nih.gov.
- ChemIDplus, (2017) โครงสร้าง 3 มิติของ 1313-82-2 - โซเดียมซัลไฟด์ [ภาพ] ดึงจาก: chem.nlm.nih.gov.
- ChemIDplus, (2017) โครงสร้าง 3 มิติของ 1313-84-4 - โซเดียมซัลไฟด์ [ภาพ] ดึงจาก: chem.nlm.nih.gov.
- สำนักงานเคมีภัณฑ์แห่งยุโรป (ECHA) (2017) บทสรุปของการจำแนกประเภทและการติดฉลาก.
- การจัดประเภทที่สอดคล้องกัน - ภาคผนวก VI ของกฎข้อบังคับ (EC) หมายเลข 1272/2008 (ระเบียบ CLP) โซเดียมซัลไฟด์ สืบค้นเมื่อวันที่ 16 มกราคม 2017 จาก: echa.europa.eu.
- สำนักงานเคมีภัณฑ์แห่งยุโรป (ECHA) (2017) บทสรุปของการจำแนกประเภทและการติดฉลาก.
- การจำแนกและการติดฉลากที่แจ้งเตือน โซเดียมซัลไฟด์ สืบค้นเมื่อวันที่ 16 มกราคม 2017 จาก: echa.europa.eu.
- ธนาคารข้อมูลสารอันตราย (HSDB) TOXNET (2017) โซเดียมซัลไฟด์ Bethesda, MD, EU: หอสมุดแห่งชาติการแพทย์ ดึงมาจาก: toxnet.nlm.nih.gov.
- Lange, L. , & Triebel, W. (2000) ซัลไฟด์, โพลีซัลไฟด์และซัลเฟน ในสารานุกรมเคมีอุตสาหกรรมของ Ullmann Wiley-VCH Verlag GmbH & Co. KGaA ดึงจาก dx.doi.org.
- สหประชาชาติ (2558) ระบบที่กลมกลืนกันทั่วโลกสำหรับการจำแนกประเภทและการติดฉลากของผลิตภัณฑ์เคมี (SGA) ฉบับที่หกฉบับปรับปรุง New York, United States: สิ่งพิมพ์ของสหประชาชาติ ดึงมาจาก: unece.org.
- ศูนย์ข้อมูลเทคโนโลยีชีวภาพแห่งชาติ. PubChem ฐานข้อมูลแบบผสม (2016) Sodium Sulfide enneahydrate - โครงสร้าง PubChem [ภาพ] ดึงจาก: pubchem.ncbi.nlm.nih.gov.
- ศูนย์ข้อมูลเทคโนโลยีชีวภาพแห่งชาติ. PubChem ฐานข้อมูลแบบผสม (2017) โซเดียมโมโนโซเดียมซัลไฟด์ Bethesda, MD, EU: หอสมุดแห่งชาติการแพทย์ สืบค้นจาก: pubchem.ncbi.nlm.nih.gov.
- ศูนย์ข้อมูลเทคโนโลยีชีวภาพแห่งชาติ. PubChem ฐานข้อมูลแบบผสม (2017) โซเดียมซัลไฟด์ enneahydrate Bethesda, MD, EU: หอสมุดแห่งชาติการแพทย์ สืบค้นจาก: pubchem.ncbi.nlm.nih.gov.
- การบริหารมหาสมุทรและบรรยากาศแห่งชาติ (NOAA) เคมีภัณฑ์ CAMEO (2017) แผ่นข้อมูลทางเคมี โซเดียมซัลไฟด์, รัส ซิลเวอร์สปริง MD สหภาพยุโรป ดึงมาจาก: cameochemicals.noaa.gov.
- การบริหารมหาสมุทรและบรรยากาศแห่งชาติ (NOAA) เคมีภัณฑ์ CAMEO (2017) แผ่นข้อมูลกลุ่มปฏิกิริยา ซัลไฟด์อนินทรีย์ ซิลเวอร์สปริง MD สหภาพยุโรป ดึงมาจาก: cameochemicals.noaa.gov.
- Ondřej Mangl, (2007) Sulfid sodný - Na2S [ภาพ] สืบค้นจาก: wikipedia.org.
- PubChem, (2016) Sodium monosulfide [ภาพ] สืบค้นจาก: puchem.nlm.nih.gov.
- PubChem, (2016) Sodium Sulfide enneahydrate [ภาพ] สืบค้นจาก: puchem.nlm.nih.gov.
- วิกิพีเดีย (2017) ค่าสัมประสิทธิ์การแยกออกเทนอล - น้ำ สืบค้นเมื่อวันที่ 17 มกราคม 2017 จาก: wikipedia.org.
- วิกิพีเดีย (2017) โซเดียมซัลไฟด์ สืบค้นเมื่อวันที่ 17 มกราคม 2017 จาก: wikipedia.org.


