เกลืออินทรีย์คุณสมบัติทางกายภาพและทางเคมีการใช้และตัวอย่าง
เกลืออินทรีย์ พวกมันเป็นสารประกอบไอออนิกที่หนาแน่นซึ่งมีคุณสมบัติมากมายนับไม่ถ้วน พวกเขาได้รับมาก่อนหน้านี้จากสารประกอบอินทรีย์ซึ่งได้รับการเปลี่ยนแปลงที่อนุญาตให้มันเป็นพาหะของประจุไฟฟ้าและลักษณะทางเคมีของมันก็ขึ้นอยู่กับไอออนที่เกี่ยวข้อง.
ในภาพด้านล่างแสดงสูตรทางเคมีทั่วไปสองสูตรสำหรับเกลืออินทรีย์ R-AX แรกถูกตีความว่าเป็นสารประกอบที่มีโครงสร้างคาร์บอนอะตอมหรือกลุ่ม A มีประจุเป็นบวก + หรือลบ (-).
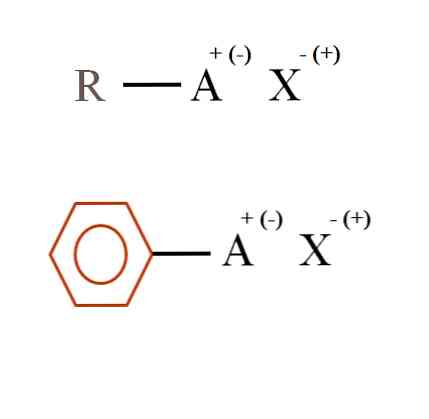
จะเห็นได้ว่ามีพันธะโควาเลนต์ระหว่าง R และ A, R-A แต่ในทางกลับกัน A มีประจุอย่างเป็นทางการที่ดึงดูดไอออนไอออน (หรือ repels) สัญลักษณ์ X ของประจุจะขึ้นอยู่กับลักษณะของ A และสภาพแวดล้อมทางเคมี.
ถ้า A เป็นบวกมันจะมีปฏิสัมพันธ์กับ X เท่าใด มีเพียงอันเดียวที่ได้รับหลักการของ electroneutrality (+ 1-1 = 0) อย่างไรก็ตามตัวตนของ X คืออะไร? ประจุลบ X อาจเป็น CO32-, ต้องใช้สองไอออนบวก RA+; ฟลูออไรด์: F-, Cl-, br-, ฯลฯ หรือแม้กระทั่งสารประกอบ RA อื่น-. ตัวเลือกนั้นไม่สามารถคำนวณได้.
นอกจากนี้เกลือออร์แกนิกอาจมีกลิ่นหอมซึ่งแสดงในวงแหวนเบนซีนสีน้ำตาล เกลือเบนโซเอตทองแดง (II), (C)6H5COO)2ตัวอย่างเช่น Cu ประกอบด้วยวงแหวนอะโรมาติกสองวงที่มีกลุ่มคาร์บอกซิลที่มีประจุลบซึ่งมีปฏิกิริยากับประจุบวก Cu2+.
ดัชนี
- 1 คุณสมบัติทางกายภาพและทางเคมี
- 1.1 มวลโมเลกุลสูง
- 1.2 Amphiphiles และสารลดแรงตึงผิว
- 1.3 จุดเดือดหรือจุดหลอมเหลวสูง
- 1.4 ความเป็นกรดและความเป็นพื้นฐาน
- 2 ใช้
- 3 ตัวอย่างของเกลืออินทรีย์
- 3.1 Carboxylates
- 3.2 ลิเธียมไดอะคริเลต
- 3.3 เกลือของซัลโฟเนียม
- 3.4 Salts of oxonium
- 3.5 Amine salts
- 3.6 เกลือ Diazonium
- 4 อ้างอิง
คุณสมบัติทางกายภาพและทางเคมี
จากภาพสามารถกล่าวได้ว่าเกลืออินทรีย์ประกอบด้วยองค์ประกอบสามส่วน: สารอินทรีย์, R หรือ Ar (วงแหวนที่มีกลิ่นหอม), อะตอมหรือกลุ่มที่มีประจุไอออนิก A และประจุ X.
เช่นเดียวกับเอกลักษณ์ทางเคมีและโครงสร้างที่กำหนดโดยส่วนประกอบดังกล่าวดังนั้นคุณสมบัติของพวกมันจึงขึ้นอยู่กับ.
จากข้อเท็จจริงนี้สามารถสรุปคุณสมบัติทั่วไปบางอย่างที่ตรงกับเกลือเหล่านี้ส่วนใหญ่.
มวลโมเลกุลสูง
สมมติว่าโมโนไอออนหรืออนินทรีย์อนินทรีย์ X, เกลืออินทรีย์มักจะมีมวลโมเลกุลที่ใหญ่กว่าเกลืออนินทรีย์ นี่คือสาเหตุหลักมาจากโครงกระดูกของคาร์บอนซึ่งมีพันธะ C-C อย่างง่ายและอะตอมไฮโดรเจนของพวกเขามีส่วนช่วยมวลจำนวนมากให้กับสารประกอบ.
ดังนั้นพวกเขาจึงเป็น R หรือ Ar รับผิดชอบน้ำหนักโมเลกุลสูงของพวกเขา.
Amphiphiles และสารลดแรงตึงผิว
เกลือออร์แกนิกเป็นสารประกอบแอมฟิฟิลิกนั่นคือโครงสร้างของพวกมันมีทั้งที่ชอบน้ำและไม่ชอบน้ำ.
อะไรที่สุดขั้วเช่นนี้? R หรือ Ar แสดงถึงจุดสิ้นสุดที่ไม่ชอบน้ำเนื่องจากอะตอม C และ H ของพวกมันไม่มีความสัมพันธ์ที่ดีกับโมเลกุลของน้ำ.
+(-), อะตอมหรือกลุ่มที่มีประจุเป็นจุดสิ้นสุดของไฮโดรฟิลิกเนื่องจากมีส่วนก่อให้เกิดโมเมนต์ขั้วและมีปฏิสัมพันธ์กับน้ำที่ก่อตัวเป็นไดโพล+ OH2).
เมื่อบริเวณที่เป็นน้ำและไม่ชอบน้ำเป็นโพลาไรซ์เกลือ amphiphilic จะกลายเป็นสารลดแรงตึงผิวซึ่งเป็นสารที่ใช้กันอย่างแพร่หลายในการผลิตผงซักฟอกและ demulsifiers.
จุดเดือดหรือจุดหลอมเหลวสูง
เช่นเดียวกับเกลืออนินทรีย์เกลืออินทรีย์ก็มีจุดหลอมเหลวและจุดเดือดสูงเนื่องจากกองกำลังไฟฟ้าสถิตที่ควบคุมในสถานะของเหลวหรือของแข็ง.
อย่างไรก็ตามมีส่วนประกอบอินทรีย์ R หรือ Ar กองกำลัง Van der Waals ประเภทอื่น (กองกำลังลอนดอน, ไดโพล - ไดโพล, สะพานไฮโดรเจน) ที่แข่งขันในลักษณะที่แน่นอนด้วยไฟฟ้าสถิต.
ด้วยเหตุผลนี้โครงสร้างที่เป็นของแข็งหรือของเหลวของเกลืออินทรีย์มีความซับซ้อนและหลากหลายมากขึ้น บางคนสามารถทำตัวเหมือน ผลึกเหลว.
ความเป็นกรดและเบส
เกลืออินทรีย์มักเป็นกรดหรือเบสที่แรงกว่าเกลืออนินทรีย์ นี่เป็นเพราะ A ตัวอย่างเช่นในเกลือเอมีนมีประจุเป็นบวกเนื่องจากพันธะของมันกับไฮโดรเจนเพิ่มเติม: A+-H. จากนั้นเมื่อสัมผัสกับฐานบริจาคโปรตอนเพื่อกลับไปเป็นสารประกอบที่เป็นกลาง:
RA+H + B => RA + HB
H เป็นของ A แต่มันถูกเขียนขึ้นเมื่อมันเข้าแทรกแซงในปฏิกิริยาการทำให้เป็นกลาง.
ในทางกลับกัน RA+ มันอาจเป็นโมเลกุลขนาดใหญ่ไม่สามารถก่อตัวเป็นของแข็งด้วยเครือข่ายผลึกมีความเสถียรเพียงพอกับไอออนไฮดรอกซิลหรือไฮดรอกซิล OH-.
เมื่อเป็นกรณีนี้เกลือ RA+OH- มันทำตัวเหมือนฐานที่แข็งแรง แม้จะเป็นพื้นฐานเหมือน NaOH หรือ KOH:
RA+OH- + HCl => RACl + H2O
สังเกตในสมการทางเคมีว่า Cl anion- มันแทนที่ OH-, สร้างเกลือ RA+Cl-.
การใช้งาน
การใช้เกลืออินทรีย์จะแตกต่างกันไปตามลักษณะเฉพาะของ R, Ar, A และ X นอกจากนี้แอปพลิเคชันที่พวกมันถูกกำหนดไว้ยังขึ้นอยู่กับชนิดของของแข็งหรือของเหลวที่เกิดขึ้น ลักษณะทั่วไปบางประการในเรื่องนี้คือ:
-พวกมันทำหน้าที่เป็นรีเอเจนต์สำหรับการสังเคราะห์สารประกอบอินทรีย์อื่น ๆ RAX สามารถทำหน้าที่เป็น "ผู้บริจาค" ของห่วงโซ่ R เพื่อเพิ่มไปยังสารประกอบอื่นแทนที่กลุ่มที่ดี.
-เป็นสารลดแรงตึงผิวจึงสามารถใช้เป็นน้ำมันหล่อลื่นได้ เกลือโลหะของ carboxylates ใช้สำหรับวัตถุประสงค์นี้.
-พวกเขาอนุญาตให้สังเคราะห์สีที่หลากหลาย.
ตัวอย่างของเกลืออินทรีย์
carboxylates
กรดคาร์บอกซิลิกทำปฏิกิริยากับไฮดรอกไซด์ในปฏิกิริยาการทำให้เป็นกลางทำให้เกิดคาร์บอกซิเลต: RCOO- M+; ที่ไหน M+ มันสามารถเป็นไอออนบวกใด ๆ (นา+, Pb2+, K+, เป็นต้น) หรือแอมโมเนียมไอออนบวก4+.
กรดไขมันคือกรดคาร์บอกซิลิกคาร์บอกซิลิกที่มีสายโซ่ยาวสามารถอิ่มตัวและไม่อิ่มตัว กรด Palmitic (CH) เป็นหนึ่งในอิ่มตัว3(CH2)14COOH) สิ่งนี้มีต้นกำเนิดจากเกลือ palmitate ในขณะที่กรดสเตียริก (CH)3(CH2)16COOH เป็นเกลือสเตียเรต สบู่ประกอบด้วยเกลือเหล่านี้.
ในกรณีของกรดเบนโซอิก6H5COOH (ที่ค6H5- มันเป็นแหวนเบนซีน) เมื่อมันทำปฏิกิริยากับฐานก่อให้เกิดเกลือเบนโซเอต ใน carboxylates ทั้งหมดกลุ่ม -COO- แสดงถึง A (RAX).
ลิเธียม dupupuprate
Lithium diacuprate มีประโยชน์ในการสังเคราะห์สารอินทรีย์ สูตรของมันคือ [R-Cu-R]-ลี้+, ซึ่งอะตอมทองแดงมีประจุลบ ที่นี่ทองแดงแสดงถึงอะตอม A ของภาพ.
เกลือซัลเฟต
พวกมันเกิดขึ้นจากปฏิกิริยาของอินทรีย์ซัลไฟด์กับอัลคิลลิด:
R2S + R'X => R2R'S+X
สำหรับเกลือเหล่านี้อะตอมกำมะถันจะมีประจุเป็นบวก (S)+) มีสามพันธะโควาเลนต์.
เกลือ Oxonium
นอกจากนี้อีเทอร์ (อะนาล็อกที่เติมออกซิเจนของซัลไฟด์) ทำปฏิกิริยากับไฮโดรไซด์เพื่อสร้างเกลือออกซาเนี่ยม:
ROR '+ HBr <=> RO+HR +-
โปรตอนที่เป็นกรดของ HBr จะถูกพันธะโควาเลนต์กับอะตอมออกซิเจนของอีเธอร์ (R2O+-H) โหลดมันบวก.
เอมีนเกลือ
เอมีนสามารถเป็นประถมศึกษาทุติยภูมิตติยภูมิหรือควอเทอร์นารีเช่นเดียวกับเกลือของพวกเขา พวกเขาทั้งหมดมีลักษณะโดยมีอะตอม H เชื่อมโยงกับอะตอมไนโตรเจน.
ดังนั้น RNH3+X- มันเป็นเกลือเอมีนหลัก R2NH2+X-, ของมีนรอง R3NH+X-, ของเอมีนตติยภูมิ; และ R4ยังไม่มีข้อความ+X-, ของ quaternary amine (เกลือแอมโมเนียมสี่).
Diazonium salts
ในที่สุดเกลือ diazonium (RN2+X-) หรือ arildiazonium (ArN)2+X-) เป็นจุดเริ่มต้นของสารประกอบอินทรีย์หลายชนิดโดยเฉพาะสีย้อมเอโซ.
การอ้างอิง
- Francis A. Carey เคมีอินทรีย์ (ฉบับที่หก, หน้า 604-605, 697-698, 924) Mc Graw Hill.
- Graham Solomons T.W. , Craig B. Fryhle เคมีอินทรีย์ เอมีน (ฉบับที่ 10) ไวลีย์พลัส.
- วิกิพีเดีย (2018) เกลือ (เคมี) นำมาจาก: en.wikipedia.org
- Steven A. Hardinger (2017) ภาพประกอบศัพท์เคมีอินทรีย์: เกลือ สืบค้นจาก: chem.ucla.edu
- เชฟรอนโอโรไนท์ (2011) carboxylates [PDF] ดึงมาจาก: oronite.com


