คุณสมบัติของแคลเซียมไฮไดรด์ (CaH2) การเกิดปฏิกิริยาและการใช้งาน
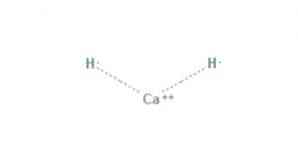
แคลเซียมไฮไดรด์ เป็นสารประกอบทางเคมีของสูตร CaH2 ซึ่งทำให้เป็นด่างของโลก สารประกอบทางเคมีนี้มีพันธะไอออนิกสองตัวระหว่างแคลเซียมและไอออนไฮไดรด์ทั้งสองดังแสดงในรูปที่ 1.
มันเป็นเกลือไฮไดรด์ซึ่งหมายความว่าโครงสร้างของมันคล้ายกับเกลือ โครงสร้างผลึกของมันเหมือนกับโครงสร้างของคลอไรด์ตะกั่ว (Cotunnite mineral) ดังแสดงในรูปที่ 2.

โลหะอัลคาไลน์และอัลคาไลน์เอิร์ ธ ทั้งหมดก่อให้เกิดไฮไดรด์ ในทางเคมีไฮไดรด์คือไฮโดรเจนไอออน H- หรือโดยทั่วไปสารประกอบที่หนึ่งหรือมากกว่าศูนย์ไฮโดรเจนมีนิวคลีโอฟิลิกลดหรือคุณสมบัติพื้นฐาน.
ในสารประกอบที่พิจารณาว่าเป็นไฮไดรด์อะตอมไฮโดรเจนจะถูกติดเข้ากับองค์ประกอบหรือกลุ่มอิเล็กโทร.
มันสามารถผลิตได้โดยทำปฏิกิริยาแคลเซียมและไฮโดรเจนที่อุณหภูมิระหว่าง 300 และ 400 องศาเซนติเกรด อีกวิธีในการเตรียมแคลเซียมไฮไดรด์คือการทำให้แคลเซียมคลอไรด์ร้อนพร้อมกับไฮโดรเจนและโลหะโซเดียม ปฏิกิริยาที่เกิดขึ้นมีดังนี้:
CaCl2 + H2 + 2Na → CaH2 + 2NaCl
ในปฏิกิริยานี้แคลเซียม (Ca) และไฮโดรเจน (H) สร้างโมเลกุลของแคลเซียมไฮไดรด์ในขณะที่อะตอมโซเดียมร่วมกับคลอรีนสร้างโมเลกุลของโซเดียมคลอไรด์ (NaCl).
แคลเซียมไฮไดรด์สามารถผลิตได้โดยการลดแคลเซียมออกไซด์ (CaO) ด้วยแมกนีเซียม (Mg) ปฏิกิริยาจะเกิดขึ้นต่อหน้าไฮโดรเจน ปฏิกิริยานี้ยังผลิตแมกนีเซียมออกไซด์ (MgO) ด้านล่างเป็นสูตรสำหรับปฏิกิริยาทางเคมีนี้:
CaO + Mg + H2 → CaH2 + MgO
ดัชนี
- 1 คุณสมบัติทางกายภาพและทางเคมีของแคลเซียมไฮไดรด์
- 2 ปฏิกิริยาและอันตราย
- 3 การจัดการและการเก็บรักษา
- 4 การใช้และแอปพลิเคชัน
- 4.1 สารดูดความชื้น
- 4.2 การผลิตไฮโดรเจน
- 4.3 ตัวแทนการลด
- 5 ข้อเสียในการใช้แคลเซียมไฮไดรด์
- 6 อ้างอิง
สมบัติทางกายภาพและเคมีของแคลเซียมไฮไดรด์
แคลเซียมไฮไดรด์เป็นชุดของผลึกที่มีโครงสร้างออร์โธฮอร์บิคสีขาวเมื่อมันบริสุทธิ์ โดยทั่วไปแล้วจะหาได้ยากในรูปแบบนี้ดังนั้นจึงมักมีเฉดสีเทา มันไม่มีกลิ่นลักษณะ ลักษณะที่ปรากฏอยู่ในรูปที่ 3 (ราชสมาคมเคมี, 2015).

มีน้ำหนักโมเลกุล 42,094 g / mol มีจุดหลอมเหลว 816 องศาเซลเซียสและความหนาแน่น 1.70 g / ml ถ้ามันละลายในน้ำจะทำปฏิกิริยาอย่างรุนแรงผลิตไฮโดรเจน นอกจากนี้ยังทำปฏิกิริยากับแอลกอฮอล์ (ศูนย์ข้อมูลเทคโนโลยีชีวภาพแห่งชาติ, S.F. ).
ปฏิกิริยาและอันตราย
แคลเซียมไฮไดรด์เป็นสารเคมีที่มีความเสถียรแม้ว่าจะมีปฏิกิริยาสูงต่อน้ำหรือความชื้น เมื่อสัมผัสกับน้ำจะปล่อยก๊าซไฮโดรเจนที่ไวไฟซึ่งสามารถจุดติดไฟได้เอง.
ถือว่าเป็นสารประกอบที่ระเบิดได้ เมื่อถูกความร้อนในปฏิกิริยากับเตตระไฮโดรฟูรามันสามารถทำให้เกิดการระเบิดได้ เมื่อผสมกับคลอเรต, ไฮโปคลอไรต์, โบรเมต, โพแทสเซียมเปอร์คลอเรตก็จะไวต่อความร้อนแรงเสียดทานและกลายเป็นวัตถุระเบิด (Calcium Hydride 7789-78-8, 2016).
เมื่อฟลูออไรด์ถูกบดขยี้ด้วยแคลเซียมไฮไดรด์มวลจะกลายเป็นไส้ การให้ความร้อนอย่างแรงของไฮไดรด์ด้วยคลอรีนโบรมีนหรือไอโอดีนทำให้เกิดการลุกติดไฟ.
ส่วนผสมของไฮไดรด์กับโบรเมตต่าง ๆ เช่นแบเรียมโบรเมตหรือคลอเรตเช่นแบเรียมคลอเรตและเพอร์คลอเรตเช่นโพแทสเซียมเปอร์คลอเรต CaH2 ทำปฏิกิริยากับซิลเวอร์ฟลูออไรด์อย่างไม่ต่อเนื่องหากมีแรงเสียดทาน.
สารประกอบนี้ต้องได้รับการจัดการภายใต้บรรยากาศเฉื่อย หากจัดการอย่างไม่เหมาะสมอาจเป็นภัยคุกคามร้ายแรงต่อสุขภาพและความปลอดภัยของบุคลากรในห้องปฏิบัติการผู้ช่วยชีวิตและผู้จัดการขยะสารเคมี (ศูนย์ UC เพื่อความปลอดภัยในห้องปฏิบัติการ, 2013).
เป็นอันตรายอย่างยิ่งในกรณีที่สัมผัสกับผิวหนังหรือดวงตาเนื่องจากมีการระคายเคือง อันตรายมากในกรณีที่สัมผัสกับผิวหนังเพราะสามารถกัดกร่อนได้.
นอกจากนี้ยังเป็นอันตรายในกรณีที่กลืนกินและสูดดม จำนวนความเสียหายของเนื้อเยื่อขึ้นอยู่กับความยาวของการติดต่อ การสัมผัสดวงตาอาจทำให้กระจกตาเสียหายหรือตาบอดได้.
การสัมผัสกับผิวหนังอาจทำให้เกิดการอักเสบและแผล การสูดดมฝุ่นจะทำให้เกิดการระคายเคืองในทางเดินอาหารหรือทางเดินหายใจโดยมีอาการไหม้แสบและไอ.
การเปิดรับแสงมากเกินไปอย่างรุนแรงสามารถทำให้ปอดถูกทำลาย, หายใจไม่ออก, หมดสติและแม้แต่เสียชีวิต การอักเสบของดวงตามีลักษณะเป็นสีแดงระคายเคืองและมีอาการคัน การอักเสบของผิวหนังมีลักษณะตามอาการคัน, ลอก, สีแดงหรือพองเป็นครั้งคราว.
การสัมผัสดวงตาซ้ำ ๆ ในระดับต่ำอาจทำให้เกิดการระคายเคืองดวงตา การสัมผัสกับผิวหนังซ้ํา ๆ อาจทําใหผิวหนังถูกทําลายหรือผิวหนังอักเสบ.
การสูดดมฝุ่นซ้ําสามารถทําให้เกิดการระคายเคืองต่อระบบทางเดินหายใจหรือปอดเสียหายได้หลายระดับ การสูดดมฝุ่นซ้ํา ๆ หรือเปนเวลานานอาจกอใหเกิดการระคายเคืองทางเดินหายใจเรื้อรัง (เอกสารขอมูลความปลอดภัยของวัสดุ Calcium hydride MSDS, 2005).
ในกรณีที่สัมผัสกับดวงตาควรล้างด้วยน้ำปริมาณมากทันทีอย่างน้อย 15 นาทียกเปลือกตาล่างและเปลือกตาบนเป็นครั้งคราว.
ในกรณีที่ถูกผิวหนังควรล้างด้วยน้ำปริมาณมากทันทีอย่างน้อย 15 นาทีโดยถอดเสื้อผ้าและรองเท้าที่เปื้อน.
ในกรณีของการกลืนกินไม่ควรทำให้อาเจียน ควรเรียกศูนย์ควบคุมพิษ ขอแนะนำให้ออกจากเว็บไซต์ของนิทรรศการและย้ายไปข้างนอกทันที.
ในกรณีที่สูดหายใจเข้าไปหากหายใจลำบากจำเป็นต้องให้ออกซิเจน ไม่ควรให้การหายใจแบบปากต่อปากหากผู้ป่วยกลืนกินหรือสูดดมสาร.
ควรใช้อุปกรณ์ช่วยหายใจแบบหน้ากากชนิดพกพาที่มีวาล์วทางเดียวหรืออุปกรณ์ทางการแพทย์ระบบหายใจที่เหมาะสม ในทุกกรณีต้องไปพบแพทย์ทันที.
การจัดการและการเก็บรักษา
สารประกอบควรเก็บในภาชนะแห้งห่างจากความร้อน ควรเก็บให้ห่างจากแหล่งกำเนิดประกายไฟ อย่าหายใจเอาฝุ่นเข้าไป ไม่ควรเติมน้ำลงในผลิตภัณฑ์นี้
ในกรณีที่การระบายอากาศไม่เพียงพอให้สวมอุปกรณ์ช่วยหายใจที่เหมาะสมเช่นหน้ากากกรอง ในกรณีของการสัมผัสคุณควรไปพบแพทย์และแสดงฉลากให้มากที่สุด หลีกเลี่ยงการสัมผัสกับผิวหนังและดวงตา.
โดยทั่วไปวัสดุที่ติดไฟได้ควรเก็บไว้ในตู้นิรภัยหรือห้องเก็บของแยกต่างหาก ปิดภาชนะบรรจุให้แน่น.
เก็บในที่เย็นและมีอากาศถ่ายเทสะดวก อุปกรณ์ทั้งหมดที่มีวัสดุเพื่อหลีกเลี่ยงประกายไฟไฟฟ้าจะต้องต่อสายดิน ควรเก็บภาชนะให้แห้งและในที่เย็น.
มันเป็นวัสดุที่ไม่ติดไฟ อย่างไรก็ตามนักผจญเพลิงจะต้องสวมใส่อุปกรณ์ที่เหมาะสมในขณะที่ดับไฟรอบ ๆ สารเคมีนี้.
ไม่แนะนำให้ใช้น้ำดับไฟรอบ ๆ แคลเซียมไฮไดรด์ สามารถใช้ทรายแห้งรวมทั้งสารประกอบเช่นโซเดียมคลอไรด์และโซเดียมคาร์บอเนตเพื่อการนี้.
ในการกำจัดของเสียออกจากแคลเซียมไฮไดรด์นั้นจะต้องถูกย่อยสลายโดยการเติมเมทานอล 25 มิลลิลิตรสำหรับแต่ละกรัมของไฮไดรด์ภายใต้บรรยากาศไนโตรเจนในขณะที่กวน.
เมื่อปฏิกิริยาเสร็จสิ้นปริมาณน้ำที่เท่ากันจะถูกเติมลงในสารประกอบแคลเซียมเมทิลไซด์ที่เป็นน้ำและปล่อยลงสู่ท่อระบายน้ำด้วยน้ำปริมาณมาก (National Research Council, 1995).
การใช้งานและการใช้งาน
ตัวแทนสารดูดความชื้น
โพแทสเซียมไฮไดรด์เป็นสารดูดความชื้นที่ไม่รุนแรง ด้วยเหตุนี้การใช้สารนี้ในฐานะสารดูดความชื้นจึงปลอดภัยกว่าเมื่อเปรียบเทียบกับสารที่ทำปฏิกิริยาได้มากกว่าเช่นโซเดียมโพแทสเซียมและโลหะผสมโซเดียม ทำปฏิกิริยากับน้ำด้วยวิธีต่อไปนี้:
CaH2 + 2 H2O → Ca (OH) 2 + 2 H2
ผลิตภัณฑ์ไฮโดรไลซิสของปฏิกิริยานี้ไฮโดรเจน (แก๊ส) และ Ca (OH) 2 (ส่วนผสมที่เป็นน้ำ) สามารถแยกออกจากตัวทำละลายสารเคมีหลังจากกระบวนการกรองการกลั่นหรือการแยกตัวออกจากกัน.
สารประกอบทางเคมีนี้เป็นสารดูดความชื้นที่มีประสิทธิภาพสำหรับตัวทำละลายพื้นฐานหลายชนิดเช่นเอมีนและไพริดีน บางครั้งมันถูกใช้เพื่อตัวทำละลายก่อนแห้งก่อนใช้สารดูดความชื้นที่ทำปฏิกิริยาได้มากขึ้น.
การผลิตไฮโดรเจน
ในปี 1940 สารประกอบนี้มีให้เป็นแหล่งของไฮโดรเจนภายใต้ชื่อทางการค้าของ "Hydrolith".
มันถูกใช้เป็นแหล่งของไฮโดรเจนมาเป็นเวลานาน มันยังคงใช้ในการผลิตไฮโดรเจนบริสุทธิ์ในห้องปฏิบัติการสำหรับการทดลองต่าง ๆ เซลล์เชื้อเพลิงขั้นสูงและการใช้งานแบตเตอรี่ (American Elements, S.F. ).
สารประกอบนี้ถูกนำมาใช้กันอย่างแพร่หลายมานานหลายสิบปีในฐานะวิธีบอลลูนที่ปลอดภัยและสะดวก.
เช่นเดียวกันมันถูกใช้เป็นประจำในห้องปฏิบัติการเพื่อผลิตไฮโดรเจนบริสุทธิ์จำนวนเล็กน้อยสำหรับการทดลอง ปริมาณความชื้นของเชื้อเพลิงดีเซลคำนวณโดยไฮโดรเจนที่พัฒนาขึ้นหลังการรักษาด้วย CaH2.
ตัวแทนลด
เมื่อความร้อนระหว่าง 600 ถึง 1,000 องศาเซลเซียสเซอร์โคเนียมออกไซด์ไนโอเบียมยูเรเนียมโครเมียมไทเทเนียมวาเนเดียมและแทนทาลัมสามารถลดลงเพื่อเตรียมผงโลหะเหล่านี้เพื่อให้สามารถใช้แคลเซียมไฮไดรด์ในโลหะวิทยา ของฝุ่น.
ปฏิกิริยาต่อไปนี้แสดงให้เห็นถึงวิธีที่แคลเซียมไฮไดรด์ทำหน้าที่เป็นตัวรีดิวซ์:
TiO + 2CaH2 → CaO + H2 + Ti
ข้อเสียในการใช้แคลเซียมไฮไดรด์
สารเคมีนี้มักจะเป็นตัวเลือกที่ต้องการเป็นตัวแทนการอบแห้ง อย่างไรก็ตามมันมีข้อเสียบางประการเช่น:
-การกระทำการอบแห้งของสารประกอบนี้ช้าเนื่องจากไม่ละลายในตัวทำละลายใด ๆ ที่ไม่ได้ทำปฏิกิริยาอย่างรุนแรง.
-สารประกอบผงนี้เข้ากันไม่ได้กับตัวทำละลายจำนวนมาก ปฏิกิริยาของคุณกับคลอโรคาร์บอนนั้นอาจทำให้เกิดการระเบิดได้.
-มันไม่สามารถใช้สำหรับตัวทำละลายออกซิเจนเนื่องจากไม่สามารถกำจัดออกซิเจนที่ละลายได้.
-การแยกความแตกต่างระหว่างแคลเซียมไฮไดรด์และแคลเซียมไฮดรอกไซด์นั้นค่อนข้างยากเนื่องจากรูปร่างหน้าตาคล้ายกัน.
การอ้างอิง
- องค์ประกอบอเมริกัน ( S.F. ) แคลเซียมไฮไดรด์ สืบค้นจาก americanelements.com: americanelements.com.
- แคลเซียมไฮไดรด์ 7789-78-8 (2016) ดึงมาจาก chemicalbook.com: chemicalbook.com.
- แคลเซียมไฮไดรด์ ( N.d. ) สืบค้นจากวิชาเคมี: chemistrylearner.com.
- เอกสารข้อมูลความปลอดภัยของวัสดุแคลเซียมไฮไดรด์ MSDS (2005, 10 ตุลาคม) สืบค้นจาก sciencelab.com: sciencelab.com.
- ศูนย์ข้อมูลเทคโนโลยีชีวภาพแห่งชาติ. ( S.F. ) PubChem ฐานข้อมูลแบบผสม; CID = 105052 สืบค้นจาก pubchem.ncbi.nlm.nih.gov: pubchem.ncbi.nlm.nih.gov.
- สภาวิจัยแห่งชาติ (1995) การปฏิบัติอย่างรอบคอบในห้องปฏิบัติการ: การจัดการและการกำจัดสารเคมี Washinton: NationalAcademy Press.
- ราชสมาคมเคมี (2015) แคลเซียมไฮไดรด์ ID 94784 สืบค้นจาก chemspider.com: chemspider.com.
- ศูนย์ UC เพื่อความปลอดภัยในห้องปฏิบัติการ (2013, 18 มกราคม) ขั้นตอนการปฏิบัติมาตรฐานแคลเซียมไฮไดรด์ สืบค้นจาก chemengr.ucsb.edu: chemengr.ucsb.edu.


