โครงสร้างอีเทนคุณสมบัติการใช้งานและความเสี่ยง
อีเทน เป็นไฮโดรคาร์บอนอย่างง่ายของสูตร C2H6 ด้วยธรรมชาติของก๊าซไม่มีสีและไม่มีกลิ่นซึ่งมีประโยชน์อย่างมากและมีความหลากหลายในการสังเคราะห์เอทิลีน นอกจากนี้ยังเป็นหนึ่งในก๊าซภาคพื้นดินที่ถูกตรวจพบในดาวเคราะห์อื่นและดาวฤกษ์อื่น ๆ รอบ ๆ ระบบสุริยะ มันถูกค้นพบโดยนักวิทยาศาสตร์ Michael Faraday ในปี ค.ศ. 1834.
ในบรรดาสารประกอบอินทรีย์จำนวนมากที่เกิดขึ้นจากอะตอมของคาร์บอนและไฮโดรเจน (หรือที่เรียกว่าไฮโดรคาร์บอน) มีธาตุที่อยู่ในสถานะก๊าซที่อุณหภูมิและแรงกดดันด้านสิ่งแวดล้อมซึ่งมีการใช้อย่างมากในหลายอุตสาหกรรม.
สิ่งเหล่านี้มักจะมาจากส่วนผสมของก๊าซที่เรียกว่า "ก๊าซธรรมชาติ" ซึ่งเป็นผลิตภัณฑ์ที่มีมูลค่าสูงสำหรับมนุษยชาติและประกอบด้วยมีเทนชนิดมีเธนอีเทนโพรเพนและบิวเทน จำแนกตามปริมาณของอะตอมคาร์บอนในห่วงโซ่.
ดัชนี
- 1 โครงสร้างทางเคมี
- 1.1 การสังเคราะห์อีเทน
- 2 คุณสมบัติ
- 2.1 การละลายของอีเทน
- 2.2 การตกผลึกของอีเทน
- 2.3 การเผาไหม้ของอีเธน
- 2.4 อีเทนในบรรยากาศและในท้องฟ้า
- 3 ใช้
- 3.1 การผลิตเอทิลีน
- 3.2 การฝึกอบรมสารเคมีขั้นพื้นฐาน
- 3.3 สารทำความเย็น
- 4 ความเสี่ยงของอีเทน
- 5 อ้างอิง
โครงสร้างทางเคมี
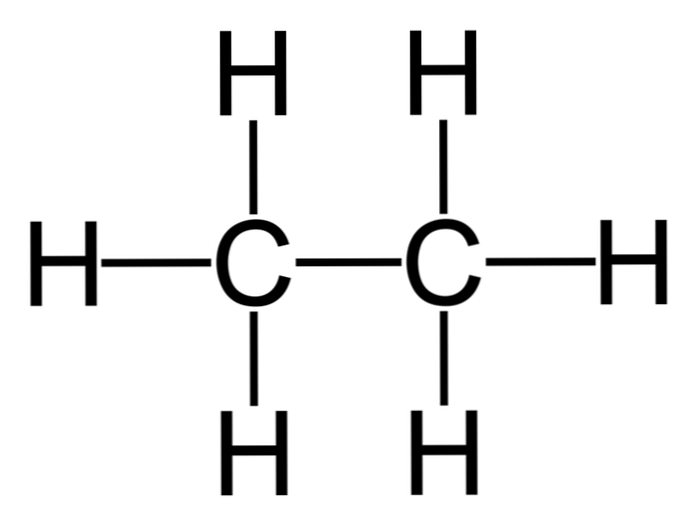
อีเทนเป็นโมเลกุลที่มีสูตร C2H6, มักจะถูกมองว่าเป็นสหภาพของกลุ่มเมธิลสองกลุ่ม (-CH3) เพื่อสร้างไฮโดรคาร์บอนของพันธะคาร์บอนคาร์บอน นอกจากนี้ยังเป็นสารประกอบอินทรีย์ที่ง่ายที่สุดหลังจากมีเธนแสดงดังนี้
H3C-CH3
อะตอมของคาร์บอนในโมเลกุลนี้มี sp hybridization3, ดังนั้นพันธะโมเลกุลจึงมีการหมุนฟรี.
นอกจากนี้ยังมีปรากฏการณ์ที่แท้จริงของอีเทนซึ่งอยู่บนพื้นฐานของการหมุนของโครงสร้างโมเลกุลของเดียวกันและพลังงานขั้นต่ำที่จำเป็นในการสร้างการหมุนของพันธะ 360 องศาซึ่งนักวิทยาศาสตร์เรียกว่า "อีเทนกั้น".
ด้วยเหตุนี้อีเทนสามารถเกิดขึ้นได้ในรูปแบบที่แตกต่างกันไปตามการหมุนของมันแม้ว่าจะมีโครงสร้างที่มีความเสถียรมากกว่าซึ่งไฮโดรเจนอยู่ตรงข้ามกัน (ดังแสดงในรูป).

การสังเคราะห์อีเทน
อีเทนสามารถสังเคราะห์ได้อย่างง่ายดายจากอิเล็กโทรไลซิสของ Kolbe ซึ่งเป็นปฏิกิริยาอินทรีย์ที่เกิดขึ้นสองขั้นตอน: การแยกสารเคมีด้วยไฟฟ้า (กำจัดกลุ่มคาร์บอกซิลและการปล่อยก๊าซคาร์บอนไดออกไซด์) ของกรดคาร์บอกซิลิกสองชนิด intermediates เพื่อสร้างพันธะโควาเลนต์.
อิเล็กโทรไลซิสของกรดอะซิติกนำไปสู่การก่อตัวของอีเธนและคาร์บอนไดออกไซด์และปฏิกิริยานี้ถูกใช้เพื่อสังเคราะห์สารแรก.
การเกิดออกซิเดชันของอะซิติกแอนไฮไดรด์โดยการกระทำของเปอร์ออกไซด์ซึ่งเป็นแนวคิดที่คล้ายกับอิเล็กโทรไลซิสของ Kolbe ก็ส่งผลให้เกิดการก่อตัวของอีเทน.
ในทำนองเดียวกันมันสามารถแยกได้อย่างมีประสิทธิภาพจากก๊าซธรรมชาติและมีเธนโดยกระบวนการทำให้เป็นของเหลวโดยใช้ระบบการแช่แข็งเพื่อจับก๊าซนี้และแยกออกจากสารผสมกับก๊าซอื่น ๆ.
กระบวนการเทอร์โบเอ็กซ์แพนชันเป็นที่ต้องการสำหรับบทบาทนี้: ส่วนผสมของก๊าซจะถูกส่งผ่านกังหันสร้างการขยายตัวจนกระทั่งอุณหภูมิลดลงต่ำกว่า-100ºC.
เมื่อมาถึงจุดนี้ส่วนประกอบของส่วนผสมสามารถสร้างความแตกต่างเพื่อให้อีเทนเหลวจะถูกแยกออกจากก๊าซมีเทนและชนิดอื่น ๆ ที่เกี่ยวข้องกับการใช้งานของการกลั่น.
สรรพคุณ
อีเทนเกิดขึ้นตามธรรมชาติในรูปของก๊าซไร้กลิ่นและไม่มีสีที่ความดันและอุณหภูมิมาตรฐาน (1 atm และ 25 ° C) มันมีจุดเดือด -88.5 ºCและจุดหลอมเหลวที่ -182.8 ºC นอกจากนี้จะไม่ได้รับผลกระทบจากการสัมผัสกับกรดหรือเบสที่แรง.
การละลายของเอทานอล
โมเลกุลของอีเธนนั้นมีรูปทรงสมมาตรและมีแรงดึงดูดที่ดึงดูดพวกมันเข้าด้วยกันเรียกว่ากองกำลังแห่งการกระจายตัว.
เมื่ออีเทนพยายามที่จะละลายในน้ำแรงดึงดูดที่เกิดขึ้นระหว่างก๊าซและของเหลวจะอ่อนแอมากดังนั้นจึงเป็นการยากที่จะเข้าร่วมอีเทนกับโมเลกุลของน้ำ.
ด้วยเหตุนี้ความสามารถในการละลายของอีเทนต่ำมากเพิ่มขึ้นเล็กน้อยเมื่อความดันของระบบเพิ่มขึ้น.
การตกผลึกของอีเทน
อีเทนสามารถทำให้เป็นก้อนแข็งส่งผลให้เกิดการก่อตัวของผลึกอีเทนที่ไม่เสถียรด้วยโครงสร้างผลึกแบบลูกบาศก์.
ด้วยอุณหภูมิที่ลดลงเกิน -183.2 ° C โครงสร้างนี้กลายเป็น monoclinic เพิ่มความเสถียรของโมเลกุล.
การเผาไหม้อีเทน
ไฮโดรคาร์บอนนี้แม้ว่าจะไม่ได้ใช้กันอย่างแพร่หลายเป็นเชื้อเพลิงสามารถนำมาใช้ในกระบวนการเผาไหม้เพื่อสร้างก๊าซคาร์บอนไดออกไซด์น้ำและความร้อนซึ่งเป็นตัวแทนดังต่อไปนี้:
2C2H6 + 7O2 → 4CO2 + 6H2O + 3120 kJ
นอกจากนี้ยังมีความเป็นไปได้ในการเผาไหม้โมเลกุลนี้โดยไม่ต้องใช้ออกซิเจนมากเกินไปซึ่งเรียกว่า "การเผาไหม้ที่ไม่สมบูรณ์" และส่งผลให้เกิดการก่อตัวของคาร์บอนอสัณฐานและคาร์บอนมอนอกไซด์ในปฏิกิริยาที่ไม่พึงประสงค์ขึ้นอยู่กับปริมาณออกซิเจนที่ใช้ :
2C2H6 + 3O2 → 4C + 6H2O + ความร้อน
2C2H6 + 4O2 → 2C + 2CO + 6H2O + ความร้อน
2C2H6 + 5o2 → 4CO + 6H2O + ความร้อน
ในบริเวณนี้การเผาไหม้เกิดขึ้นจากปฏิกิริยาอนุมูลอิสระหลายชุดซึ่งมีการระบุไว้ในปฏิกิริยาต่าง ๆ นับร้อย ตัวอย่างเช่นสารประกอบเช่นฟอร์มัลดีไฮด์, อะซีตัลดีไฮด์, มีเธน, เมทานอลและเอทานอลสามารถเกิดขึ้นได้ในปฏิกิริยาการเผาไหม้ที่ไม่สมบูรณ์.
นี้จะขึ้นอยู่กับเงื่อนไขภายใต้ปฏิกิริยาที่เกิดขึ้นและปฏิกิริยาอนุมูลอิสระที่เกี่ยวข้อง เอทิลีนยังสามารถเกิดขึ้นที่อุณหภูมิสูง (600-900 ºC) ซึ่งเป็นผลิตภัณฑ์ที่ต้องการอย่างมากจากอุตสาหกรรม.
อีเทนในบรรยากาศและเทห์ฟากฟ้า
อีเทนปรากฏอยู่ในชั้นบรรยากาศของดาวเคราะห์โลกในร่องรอยและเป็นที่น่าสงสัยว่ามนุษย์มีการจัดการเพื่อเพิ่มความเข้มข้นนี้เป็นสองเท่านับตั้งแต่เขาเริ่มฝึกกิจกรรมอุตสาหกรรม.
นักวิทยาศาสตร์คิดว่าการมีอยู่ของอีเทนในชั้นบรรยากาศส่วนใหญ่เกิดจากการเผาไหม้เชื้อเพลิงฟอสซิลแม้ว่าการปล่อยก๊าซอีเทนทั่วโลกนั้นลดลงเกือบครึ่งเนื่องจากเทคโนโลยีการผลิตก๊าซจากชั้นหินได้รับการปรับปรุง แหล่งก๊าซธรรมชาติ).
สปีชีส์นี้ยังเกิดขึ้นเองตามธรรมชาติโดยผลกระทบของรังสีดวงอาทิตย์ต่อก๊าซมีเทนในบรรยากาศซึ่งรวมตัวกันใหม่และกลายเป็นโมเลกุลของอีเทน.
อีเทนมีสถานะเป็นของเหลวบนพื้นผิวของไททันซึ่งเป็นหนึ่งในดวงจันทร์ของดาวเสาร์ สิ่งนี้เกิดขึ้นในปริมาณที่มากขึ้นในแม่น้ำวิดฟลูมินาซึ่งไหลมากกว่า 400 กิโลเมตรไปยังทะเลแห่งหนึ่ง มันยังได้รับการพิสูจน์สารประกอบนี้บนดาวหางและบนพื้นผิวของดาวพลูโต.
การใช้งาน
การผลิตเอทิลีน
การใช้อีเทนขึ้นอยู่กับการผลิตเอทิลีนซึ่งเป็นผลิตภัณฑ์อินทรีย์ที่ใช้กันอย่างแพร่หลายมากที่สุดในการผลิตของโลกผ่านกระบวนการที่เรียกว่าการแคร็กไอน้ำ.
กระบวนการนี้ประกอบด้วยการส่งผ่านอีเทนที่เจือจางด้วยไอน้ำไปยังเตาอบทำให้ร้อนโดยไม่มีออกซิเจน.
ปฏิกิริยาเกิดขึ้นที่อุณหภูมิสูงมาก (ระหว่าง 850 ถึง 900 ºC) แต่เวลาที่อยู่อาศัย (เวลาที่ใช้โดยอีเทนในเตาอบ) จะต้องสรุปโดยย่อเพื่อให้ปฏิกิริยามีประสิทธิภาพ ที่อุณหภูมิสูงกว่าจะสร้างเอทธิลีนเพิ่มขึ้น.
การฝึกอบรมสารเคมีขั้นพื้นฐาน
อีเทนยังได้รับการศึกษาเป็นองค์ประกอบหลักในการก่อตัวของสารเคมีพื้นฐาน การออกซิเดชั่นคลอไรด์เป็นหนึ่งในกระบวนการที่เสนอให้รับไวนิลคลอไรด์ (ส่วนประกอบของพีวีซี) ซึ่งแทนที่ราคาไม่แพงและซับซ้อนกว่า.
สารทำความเย็น
ในที่สุดอีเทนถูกนำมาใช้เป็นสารทำความเย็นในระบบแช่แข็งทั่วไปและยังแสดงความสามารถในการแช่แข็งตัวอย่างขนาดเล็กในห้องปฏิบัติการเพื่อการวิเคราะห์.
มันใช้แทนน้ำได้ดีมากซึ่งใช้เวลานานกว่าในการทำให้ตัวอย่างเย็นให้เย็นลงและยังสามารถสร้างการก่อตัวของผลึกน้ำแข็งที่เป็นอันตรายได้.
ความเสี่ยงของอีเทน
-อีเทนมีความสามารถในการจุดติดไฟโดยเฉพาะเมื่อมันจับกับอากาศ ที่ร้อยละของปริมาณอีเธน 3.0 ถึง 12.5% ในอากาศส่วนผสมที่อาจระเบิดได้.
-มันสามารถ จำกัด ออกซิเจนในอากาศที่พบและด้วยเหตุนี้มันจึงแสดงถึงปัจจัยเสี่ยงของการหายใจไม่ออกสำหรับคนและสัตว์ที่มีอยู่และสัมผัส.
-อีเทนในรูปของเหลวแช่แข็งสามารถเผาไหม้ผิวหนังอย่างรุนแรงหากสัมผัสโดยตรงกับมันและยังทำหน้าที่เป็นสื่อกลางในการแช่แข็งสำหรับวัตถุใด ๆ ที่สัมผัสกับมันแช่แข็งในช่วงเวลา.
-ไอระเหยของอีเธนเหลวหนักกว่าอากาศและมีความเข้มข้นบนพื้นดินสิ่งนี้สามารถแสดงถึงความเสี่ยงของการจุดระเบิดที่สามารถสร้างปฏิกิริยาการเผาไหม้แบบลูกโซ่.
-การกลืนกินอีเทนอาจทำให้เกิดอาการคลื่นไส้อาเจียนและมีเลือดออกภายใน การสูดดมนอกเหนือจากการสำลักทำให้เกิดอาการปวดหัวสับสนและอารมณ์แปรปรวน ความตายเนื่องจากภาวะหัวใจหยุดเต้นเป็นไปได้ที่มีความเสี่ยงสูง.
-มันแสดงให้เห็นถึงก๊าซเรือนกระจกที่ร่วมกับมีเธนและคาร์บอนไดออกไซด์ที่ก่อให้เกิดภาวะโลกร้อนและการเปลี่ยนแปลงสภาพภูมิอากาศที่เกิดจากมลพิษของมนุษย์ โชคดีที่มันมีความอุดมสมบูรณ์และทนทานน้อยกว่ามีเธนและดูดซับรังสีน้อยกว่านี้.
การอ้างอิง
- Britannica, E. (s.f. ) ก๊าซอีเทน สืบค้นจาก britannica.com
- Nes, G. V. (s.f. ) โครงสร้างผลึกเดี่ยวและการกระจายความหนาแน่นของอิเล็กตรอนของอีเทน, เอทิลีนและอะเซทิลีน กู้คืนจาก rug.nl
- Sites, G. (s.f. ) อีเทน: แหล่งที่มาและที่จม เรียกดูจาก sites.google.com
- SoftSchools ( N.d. ) สูตรอีเทน กู้คืนจาก softschools.com
- วิกิพีเดีย ( N.d. ) ก๊าซอีเทน สืบค้นจาก en.wikipedia.org


