พลังงานการกระตุ้นทางเคมีสิ่งที่มันประกอบไปด้วยการคำนวณ
พลังงานกระตุ้นทางเคมี (จากมุมมองของการศึกษาเกี่ยวกับการเคลื่อนไหว) หมายถึงปริมาณพลังงานที่น้อยที่สุดที่เป็นไปได้ในการเริ่มทำปฏิกิริยาเคมี ตามทฤษฎีการชนในจลนพลศาสตร์ของสารเคมีกล่าวกันว่าโมเลกุลทุกโมเลกุลที่เคลื่อนที่มีพลังงานจลน์จำนวนหนึ่ง.
ซึ่งหมายความว่ายิ่งความเร็วในการเคลื่อนที่ของคุณสูงขึ้นเท่าไรพลังงานของจลน์ของคุณก็จะยิ่งมากขึ้นเท่านั้น ในแง่นี้โมเลกุลที่มีการเคลื่อนที่อย่างรวดเร็วไม่สามารถแบ่งออกเป็นชิ้นส่วนด้วยตัวเองดังนั้นการชนจะต้องเกิดขึ้นระหว่างมันกับโมเลกุลอื่นเพื่อให้ปฏิกิริยาทางเคมีเกิดขึ้นได้.
เมื่อสิ่งนี้เกิดขึ้น - เมื่อมีการปะทะกันเกิดขึ้นระหว่างโมเลกุล - พลังงานจลน์ของเศษส่วนจะถูกเปลี่ยนเป็นพลังงานสั่นสะเทือน ในทำนองเดียวกันถ้าในตอนต้นของกระบวนการพลังงานจลน์สูงโมเลกุลที่มีส่วนร่วมในการชนจะแสดงการสั่นสะเทือนที่ยิ่งใหญ่จนบางส่วนของพันธะเคมีจะแตกหัก.
การเชื่อมโยงที่ไม่หยุดยั้งนี้เป็นขั้นตอนแรกในการเปลี่ยนสารตั้งต้นเป็นผลิตภัณฑ์ นั่นคือในการก่อตัวของเหล่านี้ ในทางตรงกันข้ามถ้าในตอนต้นของกระบวนการนี้พลังงานจลน์มีขนาดเล็กก็จะมีปรากฏการณ์ "รีบาวด์" ของโมเลกุลซึ่งจะแยกออกจากกันในทางปฏิบัติ.
ดัชนี
- 1 ประกอบด้วยอะไร?
- 1.1 เปิดใช้งานคอมเพล็กซ์
- 2 มันคำนวณอย่างไร?
- 2.1 การคำนวณพลังงานกระตุ้นของปฏิกิริยาเคมี
- 3 พลังงานกระตุ้นจะส่งผลต่อความเร็วของปฏิกิริยาอย่างไร?
- 4 ตัวอย่างการคำนวณพลังงานกระตุ้น
- 5 อ้างอิง
มันประกอบด้วยอะไร??
เริ่มต้นจากแนวคิดของการชนระหว่างโมเลกุลเพื่อเริ่มปฏิกิริยาทางเคมีที่อธิบายไว้ก่อนหน้านี้อาจกล่าวได้ว่ามีพลังงานขั้นต่ำที่จำเป็นสำหรับการชนที่จะเกิดขึ้น.
ดังนั้นหากค่าพลังงานน้อยกว่าค่าต่ำสุดที่จำเป็นนี้จะไม่มีการเปลี่ยนแปลงระหว่างโมเลกุลหลังจากการชนเกิดขึ้นซึ่งหมายความว่าเมื่อพลังงานนี้ขาดพลังงานชนิดที่เกี่ยวข้องยังคงเหมือนเดิมและจะไม่เกิดขึ้น การเปลี่ยนแปลงใด ๆ อันเนื่องมาจากแรงกระแทกนี้.
ตามลำดับความคิดพลังงานขั้นต่ำที่จำเป็นสำหรับการเปลี่ยนแปลงที่เกิดขึ้นหลังจากการชนกันระหว่างโมเลกุลเรียกว่าพลังงานกระตุ้น.
กล่าวอีกนัยหนึ่งโมเลกุลที่เกี่ยวข้องกับการกระแทกจะต้องมีพลังงานจลน์ทั้งหมดที่มีขนาดเท่ากับหรือมากกว่าพลังงานกระตุ้นเพื่อให้ปฏิกิริยาทางเคมีเกิดขึ้นได้.
นอกจากนี้ในหลายกรณีโมเลกุลจะชนกันและสร้างสายพันธุ์ใหม่ที่เรียกว่าคอมเพล็กซ์ที่เปิดใช้งานโครงสร้างซึ่งเรียกว่า "สถานะการเปลี่ยนภาพ" เพราะมันมีอยู่เพียงชั่วคราว.
มันเกิดจากสายพันธุ์สารตั้งต้นเนื่องจากการชนกันและก่อนที่จะก่อตัวของผลิตภัณฑ์ของปฏิกิริยา.
เปิดใช้งานคอมเพล็กซ์
คอมเพล็กซ์ที่ถูกกระตุ้นดังกล่าวข้างต้นก่อตัวเป็นสปีชีส์ที่มีความเสถียรต่ำมาก แต่ในทางกลับกันก็มีพลังงานที่มีศักยภาพจำนวนมาก.
แผนภาพต่อไปนี้แสดงการเปลี่ยนแปลงของสารตั้งต้นเป็นผลิตภัณฑ์ซึ่งแสดงในรูปของพลังงานและสังเกตว่าขนาดของพลังงานของสารเชิงซ้อนที่เกิดขึ้นนั้นมีค่ามากกว่าของสารตั้งต้นและผลิตภัณฑ์.
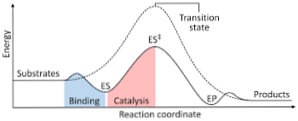
หากในตอนท้ายของปฏิกิริยาผลิตภัณฑ์มีความเสถียรมากกว่าสารตั้งต้นการปล่อยพลังงานเกิดขึ้นในรูปของความร้อนทำให้เกิดปฏิกิริยาคายความร้อน.
ในทางตรงกันข้ามถ้าสารตั้งต้นส่งผลให้เกิดความมั่นคงที่มีขนาดใหญ่กว่าผลิตภัณฑ์แสดงว่าส่วนผสมของปฏิกิริยาเกิดการดูดซับพลังงานในรูปของความร้อนจากสภาพแวดล้อมทำให้เกิดปฏิกิริยาดูดความร้อน.
ในทำนองเดียวกันหากมีกรณีใดเหตุการณ์หนึ่งเกิดขึ้นต้องสร้างไดอะแกรมเช่นที่แสดงไว้ก่อนหน้านี้ซึ่งพลังงานศักย์ของระบบที่ตอบสนองต่อความคืบหน้าหรือความคืบหน้าของปฏิกิริยา.
ด้วยวิธีนี้การเปลี่ยนแปลงพลังงานที่อาจเกิดขึ้นที่เกิดขึ้นเมื่อได้รับปฏิกิริยาและสารตั้งต้นจะถูกเปลี่ยนเป็นผลิตภัณฑ์.
มันคำนวณอย่างไร?
พลังงานกระตุ้นของปฏิกิริยาเคมีเกี่ยวข้องอย่างใกล้ชิดกับค่าคงที่ความเร็วของปฏิกิริยานั้นและการพึ่งพาค่าคงที่นี้ต่ออุณหภูมิจะถูกแทนด้วยสมการ Arrhenius:
k = Ae-Ea / RT
ในการแสดงออกนี้ k หมายถึงอัตราคงที่ของปฏิกิริยา (ซึ่งขึ้นอยู่กับอุณหภูมิ) และพารามิเตอร์ มันเรียกว่าปัจจัยความถี่และเป็นการวัดความถี่ของการชนระหว่างโมเลกุล.
สำหรับส่วนของ, และ เป็นการแสดงออกถึงพื้นฐานของชุดของลอการิทึมธรรมชาติ มันถูกยกให้เป็นพลังงานเท่ากับความฉลาดทางลบของพลังงานกระตุ้น (Ea) ระหว่างผลิตภัณฑ์ที่เกิดจากค่าคงที่ของแก๊ส (R) และอุณหภูมิสัมบูรณ์ (T) ของระบบที่ต้องพิจารณา.
ควรสังเกตว่าปัจจัยความถี่ถือได้ว่าเป็นค่าคงที่ในระบบปฏิกิริยาบางอย่างในช่วงอุณหภูมิกว้าง.
การแสดงออกทางคณิตศาสตร์นี้เดิมควรโดยนักเคมีของต้นกำเนิดดัตช์ Jacobus Henricus van't Hoff ในปี 1884 แต่ผู้ที่ให้มันถูกต้องทางวิทยาศาสตร์และตีความหลักฐานของมันคือนักเคมี Svante Arrhenius เกิดในสวีเดนในปี 1889.
การคำนวณพลังงานกระตุ้นของปฏิกิริยาเคมี
สมการ Arrhenius ชี้ให้เห็นสัดส่วนโดยตรงที่มีอยู่ระหว่างค่าคงที่ความเร็วของปฏิกิริยาและความถี่ของการปะทะกันระหว่างโมเลกุล.
นอกจากนี้สมการนี้สามารถแทนได้ด้วยวิธีที่สะดวกยิ่งขึ้นโดยการใช้คุณสมบัติของลอการิทึมธรรมชาติกับแต่ละด้านของสมการเพื่อให้ได้:
ln k = ln A - Ea / RT
เมื่อทำการจัดเรียงคำใหม่เพื่อให้ได้สมการของเส้น (y = mx + b) การแสดงออกดังต่อไปนี้จะทำได้:
ln k = (- Ea / R) (1 / T) + ln A
ดังนั้นเมื่อสร้างกราฟของ ln k เทียบกับ 1 / T เราได้เส้นตรงโดยที่ ln k แทนพิกัด y, (- A / R) หมายถึงความชันของเส้น (m), (1 / T) หมายถึงพิกัด x และ ln A หมายถึงจุดตัดที่มีแกนของพิกัด (b).
ดังที่เห็นได้ความชันที่เกิดจากการคำนวณนี้เท่ากับค่าของ -Ea / R นี่ก็หมายความว่าถ้ามันต้องการที่จะได้รับคุณค่าของพลังงานกระตุ้นโดยการแสดงออกนี้ควรมีการล้างอย่างง่ายส่งผลให้:
Ea = -mR
ที่นี่เรารู้ว่าค่าของ m และ R เป็นค่าคงที่เท่ากับ 8.314 J / K · mol.
พลังงานกระตุ้นนั้นส่งผลต่อความเร็วของปฏิกิริยาอย่างไร?
เมื่อพยายามสร้างภาพของพลังงานกระตุ้นนั้นถือได้ว่าเป็นสิ่งกีดขวางที่ไม่อนุญาตให้เกิดปฏิกิริยาระหว่างโมเลกุลพลังงานที่ต่ำกว่า.
ในปฏิกิริยาทั่วไปที่เกิดขึ้นนั้นจำนวนของโมเลกุลที่สามารถตอบสนองมีขนาดค่อนข้างใหญ่ความเร็วและพลังงานพลังงานจลน์ของโมเลกุลเหล่านี้จะเท่ากัน.
มักจะเกิดขึ้นเพียงจำนวนเล็กน้อยของโมเลกุลทั้งหมดที่พบการชนกัน - ซึ่งมีความเร็วในการเคลื่อนที่มากขึ้น - นำเสนอพลังงานจลน์ที่มากพอที่จะสามารถเอาชนะขนาดของพลังงานกระตุ้น ดังนั้นโมเลกุลเหล่านี้จึงเหมาะและสามารถเป็นส่วนหนึ่งของปฏิกิริยา.
ตามสมการของ Arrhenius เครื่องหมายลบ - ซึ่งอยู่ข้างหน้าความฉลาดระหว่างพลังงานกระตุ้นและผลผลิตของค่าคงที่ก๊าซที่อุณหภูมิสัมบูรณ์ - แสดงว่าค่าคงที่ความเร็วลดลงเมื่อมีพลังงานกระตุ้นเพิ่มขึ้น เช่นเดียวกับการเติบโตเมื่ออุณหภูมิเพิ่มขึ้น.
ตัวอย่างการคำนวณพลังงานกระตุ้น
ในการคำนวณพลังงานกระตุ้นโดยการสร้างกราฟตามสมการของ Arrhenius เรามีค่าคงที่อัตราสำหรับปฏิกิริยาการสลายตัวของอะซีตัลดีไฮด์ถูกวัดที่อุณหภูมิต่าง ๆ ห้าอุณหภูมิและเราต้องการกำหนดพลังงานกระตุ้น สำหรับปฏิกิริยาซึ่งแสดงเป็น:
CH3CHO (g) → CH4(g) + CO (g)
ข้อมูลของการวัดห้ารายการดังต่อไปนี้:
k (1 / ม1/2· S): 0.011 - 0.035 - 0.105 - 0.343 - 0.789
T (K): 700 - 730 - 760 - 790 - 810
อันดับแรกเพื่อแก้ปัญหาที่ไม่รู้จักและกำหนดพลังงานกระตุ้นเราต้องสร้างกราฟของ ln k เทียบกับ 1 / T (y vs x) เพื่อให้ได้เส้นตรงจากที่นี่ใช้ความชันและหาค่าของ Ea ตามที่อธิบายไว้.
การแปลงข้อมูลการวัดตามสมการของ Arrhenius [ln k = (- Ea / R) (1 / T) + ln A] พบค่าต่อไปนี้สำหรับ y และ x ตามลำดับ:
ln k: (-4.51) - (-3.35) - (-2.254) - (-1.070) - (-0.237)
1 / T (K-1): 1.43 * 10-3 - 1.37 * 10-3 - 1.32 * 10-3 - 1,27 * 10-3 - 1,23 * 10-3
ของค่าเหล่านี้และโดยวิธีการคำนวณทางคณิตศาสตร์ของความลาดชัน - ไม่ว่าจะในคอมพิวเตอร์หรือในเครื่องคิดเลขโดยใช้นิพจน์ m = (Y2-และ1) / (X2-X1) หรือใช้วิธีการถดถอยเชิงเส้น - เราได้รับ m = -Ea / R = -2.09 * 104 เคดังนั้น:
Ea = (8.314 J / K · mol) (2.09 * 104 K)
= 1.74 * 105 = 1.74 * 102 kJ / mol
เพื่อกำหนดพลังงานอื่น ๆ ของการเปิดใช้งานผ่านวิธีกราฟิกขั้นตอนที่คล้ายกันจะดำเนินการ.
การอ้างอิง
- วิกิพีเดีย ( N.d. ) พลังงานกระตุ้น สืบค้นจาก en.wikipedia.org
- ช้างอาร์ (2550) เคมีรุ่นที่เก้า เม็กซิโก: McGraw-Hill.
- Britannica, E. (s.f. ) พลังงานกระตุ้น สืบค้นจาก britannica.com
- มัวร์เจ. ดับบลิวและเพียร์สันอาร์. จี. (2504) จลนพลศาสตร์และกลไก ดึงมาจาก books.google.co.th
- Kaesche, H. (2003) การกัดกร่อนของโลหะ: หลักการทางเคมีฟิสิกส์และปัญหาปัจจุบัน ดึงมาจาก books.google.co.th


