โครงสร้างทางเคมีสมบัติและการใช้งานของโซเดียมโบรไมด์ (NaBr)
โซเดียมโบรไมด์ เป็นสารเคมีที่เป็นของเกลืออนินทรีย์ โครงสร้างประกอบด้วยโบรโมฮาโลเจนและองค์ประกอบโซเดียมโลหะในอัตราส่วน 1: 1 สูตรทางเคมีของมันคือ NaBr และอยู่ในสถานะของการรวมที่เป็นของแข็งภายใต้อุณหภูมิและความดันมาตรฐาน (25 ° C และ 1 atm).
โดยปกติสามารถสังเกตได้ว่าเป็นผงสีขาวและถือเป็นสารประกอบประเภทผลึกที่แสดงพฤติกรรมอุ้มน้ำ นั่นคือมันมีความสามารถในการดูดซับความชื้นจากสภาพแวดล้อม.

ในทำนองเดียวกันโซเดียมโบรไมด์มีลักษณะทางกายภาพคล้ายกับสารประกอบไอออนิกอื่นของโลหะเดียวกัน: โซเดียมคลอไรด์ คลอไรด์นี้จะแสดงเป็น NaCl ซึ่งเป็นที่รู้จักกันทั่วไปว่าเป็นเกลือทั่วไปหรือเกลือตั้งโต๊ะ.
มันมีประโยชน์มากมายในสาขาวิทยาศาสตร์ที่แตกต่างกัน ตัวอย่างเช่นมันถูกใช้ในการผลิตยาประเภทต่าง ๆ (ยาระงับประสาท, การสะกดจิต, ยากันชัก, อื่น ๆ ), เช่นเดียวกับในการสังเคราะห์สารอินทรีย์และแม้แต่ในการถ่ายภาพ.
ดัชนี
- 1 โครงสร้างทางเคมี
- 1.1 การสังเคราะห์ทางเคมี
- 2 คุณสมบัติ
- 3 ใช้
- 4 อ้างอิง
โครงสร้างทางเคมี
โซเดียมโบรไมด์เกิดขึ้นในช่วงของแข็งและเช่นเดียวกับเกลืออื่น ๆ ของธรรมชาติอนินทรีย์มีโครงสร้างผลึก.
โมเลกุลผลึกนี้ประกอบด้วยอะตอมโบรมีนและอะตอมไฮโดรเจนมีโครงสร้างของลูกบาศก์ประเภทที่มีศูนย์กลางอยู่ที่ใบหน้าเช่นเกลือ haloidal ของโลหะเดียวกัน (NaI, NaF และ NaCl).
การจัดเรียงโมเลกุลนี้เป็นพื้นฐานโครงสร้างของสารประกอบหลายชนิดซึ่งมีการเรียงลำดับเพื่อให้ไอออนแต่ละตัวอยู่ในตำแหน่งกึ่งกลางของรูปแปดด้านดังที่แสดงในภาพต่อไปนี้.
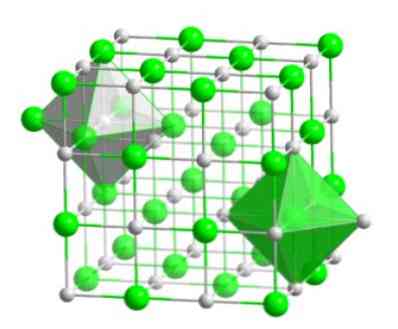
ในคริสตัลประเภทนี้คุณจะเห็นได้ว่าไอออนแต่ละตัวมีประจุอยู่รอบ ๆ มันหกไอออน - ซึ่งมีประจุไฟฟ้าที่ตรงกันข้าม - ตั้งอยู่ที่ปลายสุดของรูปแปดด้าน.
นอกจากนี้โครงสร้างของสารอิออนิคนี้ก็หมายความว่ามันมีจุดหลอมเหลวสูงประมาณ 747 ° C ซึ่งอยู่ในเชิงพาณิชย์ในสองรูปแบบ: สายพันธุ์ที่ไม่มีน้ำ (ไม่มีโมเลกุลของน้ำ) และสายพันธุ์ที่ขาดน้ำ สูตรโครงสร้าง (NaBr · 2H2O)) จุดหลอมเหลวต่างกัน.
การสังเคราะห์ทางเคมี
โซเดียมโบรไมด์เกิดจากปฏิกิริยาทางเคมีที่เกิดขึ้นระหว่างไฮโดรเจนโบรไมด์ (BrH, ไฮโดรเจนเฮไลด์ในสถานะก๊าซ) และโซเดียมไฮดรอกไซด์ (NaOH, ฐานที่แข็งแกร่งในสถานะของแข็งและมีคุณสมบัติดูดความชื้น).
ด้วยวิธีนี้มันถูกผลิตในเชิงพาณิชย์โดยการเพิ่มโบรมีนส่วนเกินในสารละลายของ NaOH รูปแบบนี้เป็นส่วนผสมของโบรไมด์ / โบรมีน ต่อมาผลิตภัณฑ์ที่ได้จะถูกระเหยจนแห้งและได้รับการบำบัดด้วยคาร์บอนเพื่อสร้างปฏิกิริยาการลดลงของโบรเมตไอออน (BrO)3-) กับไอออนโบรไมด์ (Br-).
การตอบโต้
ในทำนองเดียวกันเกลืออนินทรีย์นี้ยังสามารถผลิตได้ผ่านปฏิกิริยาการทำให้เป็นกลางของโซเดียมคาร์บอเนต (Na)2CO3) ด้วยกรดโบรมิก (HBrO)3) ทำตามขั้นตอนเดียวกับที่อธิบายไว้ข้างต้น.
โดยการสังเคราะห์สารนี้สามารถผลิตได้โดยปฏิกิริยาระหว่างเหล็กกับโบรมีนและน้ำ ในฐานะที่เป็นผลิตภัณฑ์ของปฏิกิริยานี้สปีชีส์เฟอร์รัสเฟอร์ริก.
ต่อจากนั้นสปีชีส์นี้เกิดขึ้น (แสดงเป็น FeBr2/ FeBr3) ละลายในน้ำและเติมโซเดียมคาร์บอเนตจำนวนหนึ่ง ในที่สุดสารละลายจะถูกกรองและผ่านกระบวนการระเหยเพื่อให้ได้โซเดียมโบรไมด์ในที่สุด.
สรรพคุณ
- มักพบในสถานะของแข็งรวมในรูปแบบของผงสีขาว.
- มันมีโครงสร้างผลึกที่มีการจัดเรียงโมเลกุลทรงลูกบาศก์บนใบหน้า.
- จุดหลอมเหลวของสารนี้อยู่ที่ประมาณ 747 ° C สำหรับรูปแบบแอนไฮดรัสและ 36 ° C สำหรับรูปแบบไดไฮเดรตแสดงการสลายตัวก่อนที่มันจะละลาย.
- ประกอบด้วยโซเดียมไอออน (นา+) และไอออนโบรไมด์ (Br-) มีมวลโมเลกุลหรือน้ำหนักโมเลกุล 102.89 กรัม / โมล.
- มีจุดเดือดค่อนข้างสูงอยู่ที่ 1390 ° C (เทียบเท่ากับ 2530 ° F หรือ 1660 K).
- ความสามารถในการละลายของสายพันธุ์นี้อยู่ที่ประมาณ 94.32 g / 100ml ในน้ำที่ 25 ° C เพิ่มขึ้นตามอุณหภูมิที่เพิ่มขึ้น.
- เมื่อได้รับความร้อนจนถึงจุดที่สลายตัวสารนี้จะปล่อยก๊าซโบรมีนและโซเดียมออกไซด์ซึ่งถือว่าเป็นพิษ.
- ความหนาแน่นของโซเดียมโบรไมด์ในรูปแบบปราศจากน้ำคือ 3.21 g / cm3, ในขณะที่สารประกอบไดไฮเดรตคือ 2.18 g / cm3.
- ความสามารถในการละลายแอลกอฮอล์ของเครื่องดื่มแอลกอฮอล์ถือว่าอยู่ในระดับปานกลางเช่นเดียวกับตัวทำละลายอื่น ๆ เช่นไพริดีนแอมโมเนียและไฮดราซีน.
- มันมีความไม่สามารถละลายได้กับ acetonitrile และอะซิโตน.
การใช้งาน
- ในพื้นที่ของการแพทย์จะใช้เป็นยาสำหรับเงื่อนไขจำนวนมากที่ทำให้เกิดอาการชักและเป็นการบำบัดเพื่อป้องกันโรคลมชักในผู้ป่วยที่มีอาการ Wolf-Hirschhorn, เช่นเดียวกับในการรักษายากล่อมประสาทและถูกสะกดจิต.
- ในสัตวแพทยศาสตร์ใช้ในสุนัขที่มีอาการชักเนื่องจากผลข้างเคียงของยาเช่น phenobarbital หรือ primidone.
- ในอุตสาหกรรมน้ำมันมันถูกใช้ในกระบวนการเตรียมของของเหลวบางชนิดที่มีความหนาแน่นแตกต่างกันซึ่งใช้ในบ่อน้ำมัน.
- ในด้านการวิจัยทางชีววิทยาคุณสมบัติของ microbiocidal ได้รับการพิสูจน์แล้ว นั่นคือมันถูกใช้เพื่อควบคุมการพัฒนาของแบคทีเรียชนิดต่าง ๆ.
- ในการสังเคราะห์สารอินทรีย์บางชนิดเกลือธรรมชาติของนินทรีย์นี้ใช้สำหรับการเตรียมสายพันธุ์อื่นที่ประกอบด้วยโบรมีน ยกตัวอย่างเช่นโดยปฏิกิริยาของฟินเคลสไตน์อัลคิลเฮไลด์ที่มีปฏิกิริยามากขึ้นจะได้รับซึ่งหนึ่งในนั้นมักใช้ในการถ่ายภาพ.
- ในส่วนของการทำความสะอาดและฆ่าเชื้อนั้นใช้โซเดียมโบรไมด์ร่วมกับคลอรีนเพื่อการสุขาภิบาลของน้ำปริมาณมากเช่นในสระว่ายน้ำและจากุซซี่.
การอ้างอิง
- วิกิพีเดีย ( N.d. ) โซเดียมโบรไมด์ สืบค้นจาก en.wikipedia.org
- PubChem ( N.d. ) โซเดียมโบรไมด์ สืบค้นจาก pubchem.ncbi.nlm.nih.gov
- Johnson, A. W. (1999) เชิญเคมีอินทรีย์ ดึงมาจาก books.google.co.th
- วิทยาศาสตร์โดยตรง ( N.d. ) โซเดียมโบรไมด์ ดึงมาจาก sciencedirect.com
- Riviere, J. E. และ Papich, M. G. (2009) เภสัชวิทยาและการรักษาทางสัตวแพทย์ ดึงมาจาก books.google.co.th


