เส้นทางของเฟสเพนโตสและโรคที่เกี่ยวข้อง
เส้นทางของ pentoses ฟอสเฟตยังเป็นที่รู้จักกันในนามการเบี่ยงเบนของ hexoses monophosphate เป็นเส้นทางการเผาผลาญพื้นฐานที่มีไรโบโซมเป็นผลิตภัณฑ์ขั้นสุดท้ายที่จำเป็นสำหรับเส้นทางการสังเคราะห์นิวคลีโอไทด์และกรดนิวคลีอิกเช่น DNA, RNA, ATP, NADH, FAD และโคเอนไซม์.
มันยังผลิต NADPH (nicotinamide adenine dinucleotide ฟอสเฟต) ที่ใช้ในปฏิกิริยาของเอนไซม์ต่าง ๆ เส้นทางนี้เป็นแบบไดนามิกมากและสามารถปรับผลิตภัณฑ์ขึ้นอยู่กับความต้องการชั่วขณะของเซลล์.
ATP (adenosine triphosphate) ถือเป็น "สกุลเงินพลังงาน" ของเซลล์เนื่องจากการไฮโดรไลซิสสามารถควบคู่กับปฏิกิริยาทางชีวเคมีหลากหลายรูปแบบ.
ในทำนองเดียวกัน NADPH เป็นสกุลเงินพลังงานที่สำคัญอันดับสองสำหรับการสังเคราะห์กรดไขมันการสังเคราะห์โคเลสเตอรอลการสังเคราะห์สารสื่อประสาทการสังเคราะห์ด้วยแสงและปฏิกิริยาการล้างพิษ.
แม้ว่า NADPH และ NADH มีโครงสร้างคล้ายกัน แต่ก็ไม่สามารถใช้แทนกันได้ในปฏิกิริยาทางชีวเคมี NADPH มีส่วนร่วมในการใช้พลังงานอิสระในการออกซิเดชั่นของสารบางอย่างสำหรับการสังเคราะห์ทางชีวภาพที่ลดลง.
ในทางตรงกันข้าม NADH มีส่วนร่วมในการใช้พลังงานฟรีจากออกซิเดชันของสารที่จะสังเคราะห์ ATP.
ดัชนี
- 1 ประวัติและที่ตั้ง
- 2 ฟังก์ชั่น
- 3 ขั้นตอน
- 3.1 ระยะออกซิเดทีฟ
- 3.2 เฟสที่ไม่ใช่ออกซิเดชั่น
- 4 โรคที่เกี่ยวข้อง
- 5 อ้างอิง
ประวัติและที่ตั้ง
ข้อบ่งชี้ของการดำรงอยู่ของเส้นทางนี้เริ่มต้นขึ้นในปี 2473 ต้องขอบคุณนักวิจัยอ็อตโตวอร์เบิร์กซึ่งการค้นพบของ NADP นั้นมาจากเขา+.
ข้อสังเกตบางอย่างได้รับอนุญาตให้ค้นพบเส้นทางโดยเฉพาะอย่างยิ่งความต่อเนื่องของการหายใจในที่ที่มีสารยับยั้ง glycolysis เช่นฟลูออไรด์ไอออน.
จากนั้นในปี 1950 นักวิทยาศาสตร์ Frank Dickens, Bernard Horecker, Fritz Lipmann และ Efraim Racker อธิบายทางเดินฟอสเฟตของ pentose.
เนื้อเยื่อที่เกี่ยวข้องในการสังเคราะห์คอเลสเตอรอลและกรดไขมันเช่นเต้านม, เนื้อเยื่อไขมันและไตมีความเข้มข้นสูงของเอนไซม์เพนโตสฟอสเฟต.
ตับเป็นเนื้อเยื่อที่สำคัญสำหรับทางเดินนี้: ประมาณ 30% ของการเกิดออกซิเดชันของกลูโคสในเนื้อเยื่อนี้เกิดขึ้นเนื่องจากเอนไซม์ของทางเดินของ pentose phosphate.
ฟังก์ชั่น
ทางเดินของ pentose phosphate มีหน้าที่ในการรักษาสภาวะสมดุลของคาร์บอนในเซลล์ ในทำนองเดียวกันทางเดินสังเคราะห์สารตั้งต้นของนิวคลีโอไทด์และโมเลกุลที่เกี่ยวข้องในการสังเคราะห์กรดอะมิโน (บล็อกโครงสร้างของเปปไทด์และโปรตีน).
มันเป็นแหล่งหลักของการลดพลังงานสำหรับปฏิกิริยาของเอนไซม์ นอกจากนี้ยังให้โมเลกุลที่จำเป็นสำหรับปฏิกิริยาโบลิคและกระบวนการป้องกันจากความเครียดออกซิเดชัน ระยะสุดท้ายของแทร็กมีความสำคัญในกระบวนการรีดอกซ์ภายใต้สถานการณ์ความเครียด.
ขั้นตอน
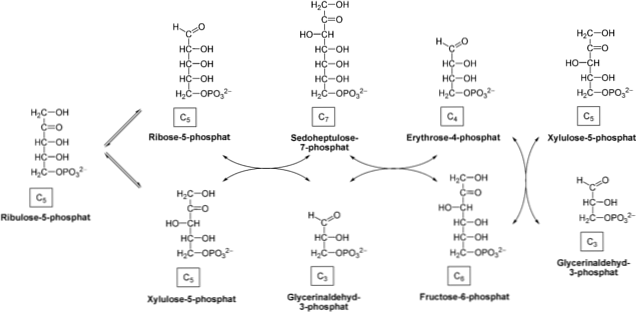
ทางเดินของ pentose phosphate ประกอบด้วยสองเฟสในเซลล์ cytosol: ตัวออกซิเดทีฟซึ่งสร้าง NADPH ด้วยการออกซิเดชั่นของกลูโคส -6-phosphate ถึง ribose-5-phosphate; และแบบไม่ออกซิเดชั่นซึ่งเกี่ยวข้องกับการแลกเปลี่ยนของน้ำตาลของคาร์โบไฮเดรตสามสี่สี่ห้าหกและเจ็ด.
เส้นทางนี้นำเสนอปฏิกิริยาที่ใช้ร่วมกันกับวัฏจักร Calvin และเส้นทาง Entner-Doudoroff ซึ่งเป็นทางเลือกแทน glycolysis.
ระยะออกซิเดทีฟ
ขั้นตอนออกซิเดทีฟเริ่มต้นด้วยการดีไฮโดรจีเนชันของโมเลกุลกลูโคส -6- ฟอสเฟตที่คาร์บอน 1 ปฏิกิริยานี้ถูกเร่งปฏิกิริยาโดยเอนไซม์กลูโคส -6- ฟอสเฟตดีไฮโดรจีเนสซึ่งมีความจำเพาะสูงโดย NADP+.
ผลิตภัณฑ์ของปฏิกิริยานี้คือ 6-phosphonoglucono-δ-lactone จากนั้นผลิตภัณฑ์นี้จะถูกไฮโดรไลซ์โดยเอนไซม์ lactonase เพื่อให้ 6-phosphogluconate สารประกอบหลังถูกใช้โดยเอนไซม์ 6-phosphogluconate dehydrogenase และกลายเป็น ribulose 5-phosphate.
เอนไซม์ phosphopentose isomerase เร่งปฏิกิริยาขั้นตอนสุดท้ายของเฟสออกซิเดชันซึ่งเกี่ยวข้องกับการสังเคราะห์ของ 5- ฟอสเฟตโดยการสร้าง isomerization ของ ribulose 5- ฟอสเฟต isomerization.
ชุดปฏิกิริยานี้ผลิตสองโมเลกุลของ NADPH และหนึ่งโมเลกุลของ ribose 5-phosphate ต่อโมเลกุลของกลูโคส 6-phosphate ที่เข้าสู่เส้นทางของเอนไซม์นี้.
ในบางเซลล์ข้อกำหนดของ NADPH นั้นมากกว่าของ ribose 5-phosphate ดังนั้นเอนไซม์ transketolase และ transaldolase ใช้ ribose 5-phosphate และเปลี่ยนเป็น glyceraldehyde 3-phosphate และ fructose 6-phosphate ซึ่งจะช่วยให้ไม่เกิดปฏิกิริยาออกซิเดชั่น สารประกอบสองตัวสุดท้ายนี้สามารถเข้าสู่เส้นทางไกลโคไลติกได้.

เฟสที่ไม่ออกซิเดชั่น
เฟสเริ่มต้นด้วยปฏิกิริยา epimerization เร่งปฏิกิริยาโดยเอนไซม์ pentose-5-phosphate epimerase เอนไซม์นี้ใช้โดย Ribulose-5-phosphate และเปลี่ยนเป็น xylulose-5-phosphate.
ผลิตภัณฑ์นี้ถ่ายโดยเอนไซม์ transketolase ซึ่งทำหน้าที่ร่วมกับโคเอนไซม์ไทอามีนไพโรฟอสเฟต (TTP) ซึ่งกระตุ้นการผ่านของไซลิโลส -5- ฟอสเฟตไปยัง ribose-5-phosphate ด้วยการถ่ายโอนคีโตสถึงอัลโตส glyceraldehyde-3-phosphate และ sedoheptulose-7-phosphate.
จากนั้นเอนไซม์ transaldolase จะทำการถ่ายโอน C3 จากโมเลกุลของ sedoheptulose-7-phosphate ไปยัง glyceraldehyde-3-phosphate ซึ่งผลิตน้ำตาลคาร์บอนสี่ (erythrose-4-phosphate) และน้ำตาลหกคาร์บอน (fructose-6) -phosphate) ผลิตภัณฑ์เหล่านี้มีความสามารถในการให้อาหารทางเดิน glycolytic.
เอนไซม์ transketosala ทำหน้าที่อีกครั้งเพื่อถ่ายโอน C2 ของไซโลโลส -5- ฟอสเฟตไปยัง erythrose-4-phosphate ส่งผลให้ฟรักโทส -6- ฟอสเฟตและ glyceraldehyde-3-phosphate ในขั้นตอนก่อนหน้าผลิตภัณฑ์เหล่านี้สามารถเข้าสู่ glycolysis.
ระยะที่สองนี้เชื่อมโยงเส้นทางที่สร้าง NADPH กับผู้ที่รับผิดชอบในการสังเคราะห์ ATP และ NADH นอกจากนี้ผลิตภัณฑ์ฟรุกโตส -6-ฟอสเฟตและไกลโคเจนดีไฮด์ -3- ฟอสเฟตสามารถเข้าสู่ gluconeogenesis.
โรคที่เกี่ยวข้อง
โรคที่แตกต่างกันนั้นสัมพันธ์กับทางเดินของเพนโตสฟอสเฟตระหว่างโรคทางประสาทและกล้ามเนื้อกับมะเร็งชนิดต่างๆ.
การศึกษาทางคลินิกส่วนใหญ่มุ่งเน้นไปที่การหาปริมาณกิจกรรมของกลูโคส -6- ฟอสเฟตดีไฮโดรจีเนสเพราะมันเป็นเอนไซม์หลักที่รับผิดชอบในการควบคุมทางเดิน.
ในเซลล์เม็ดเลือดของบุคคลที่ไวต่อโรคโลหิตจางพวกเขามีกิจกรรมเอนไซม์ต่ำของ dehydrogenase กลูโคส -6- ฟอสเฟต ในทางตรงกันข้ามเส้นเซลล์ที่เกี่ยวข้องกับสารก่อมะเร็งในกล่องเสียงแสดงกิจกรรมของเอนไซม์สูง.
NADPH มีส่วนร่วมในการผลิตกลูตาไธโอนซึ่งเป็นโมเลกุลสำคัญของเปปไทด์ในการป้องกันสายพันธุ์ออกซิเจนปฏิกิริยาซึ่งมีส่วนร่วมในความเครียดจากการเกิดออกซิเดชัน.
มะเร็งชนิดต่าง ๆ นำไปสู่การกระตุ้นการทำงานของทางเดินเพนโตสและเกี่ยวข้องกับการแพร่กระจายการสร้างเส้นเลือดใหม่และการตอบสนองต่อการรักษาด้วยเคมีบำบัด.
ในทางกลับกันโรคเรื้อรัง granulomatous พัฒนาเมื่อมีข้อบกพร่องในการผลิต NADPH.
การอ้างอิง
- Berg, J.M. , Tymoczko, J.L. , Stryer, L (2002). ชีวเคมี. WH ฟรีแมน
- Konagaya, M. , Konagaya, Y. , Horikawa, H. , & Iida, M. (1990) Pentose phosphate pathway ในการประเมินโรคเกี่ยวกับประสาทและกล้ามเนื้อของกิจกรรมกลูโคสกล้ามเนื้อ 6-phosphate dehydrogenase และ RNA. Rinsho shinkeigak ประสาทวิทยาคลินิก, 30(10), 1078-1083.
- Kowalik, M.A. , Columbano, A. , & Perra, A. (2017) บทบาทใหม่ของทางเดินเพนโตสฟอสเฟตในมะเร็งตับ. พรมแดนในด้านเนื้องอกวิทยา, 7, 87.
- Patra, K. C. , & Hay, N. (2014) ทางเดิน Pentate phosphate และมะเร็ง. แนวโน้มของวิทยาศาสตร์ชีวเคมี, 39(8), 347-354.
- Stincone, A. , Prigione, A. , Cramer, T. , Wamelink, M. , Campbell, K. , Cheung, E. , ... & Keller, M. A. (2015) การกลับมาของเมแทบอลิซึม: ชีวเคมีและสรีรวิทยาของเพนโตสฟอสเฟต. ความคิดเห็นทางชีวภาพ, 90(3), 927-963.
- Voet, D. , & Voet, J. G. (2013). ชีวเคมี. สำนักพิมพ์ Artmed.


